
题目列表(包括答案和解析)
22.(6分)NaBH4被称为有机化学中的“万能还原剂”,也是许多有机反应的催化剂,在有机化学里有极广泛的用途。
(1) 在60年代,德国拜尔药厂用下面的化学方程式把NaBH4的合成发展成工业规模:
□Na2B4O7 +□Na +□H2 + □SiO2 → □NaBH4 + □Na2SiO3
请配平这个化学方程式。
(2) NaBH4易溶于水,并会和水反应放出氢气。设以BO2--表示产物里硼的形态,试写出这个反应的离子方程式
(3)NaBH4和水的反应速率受温度、浓度以及溶液的pH控制,根据所学化学知识来说明,pH怎样控制NaBH4和水反应的速率。


21.(13分)已知不溶于水的碱受热能分解生成碱性氧化物和水。现有X、Y、Z三种不同的金属,A、B、C、D、E、F是含有它们其中某种元素的化合物。它们之间能发生如下转化:
由此推断:
(1) 白色沉淀R的化学式是 。
(2)
 写出下列三种物质的化学式:
写出下列三种物质的化学式:
A ,B ,W 。
(3)X、Y、Z三种金属的活动性由弱到强的顺序为 。
 (4)F转化为D的化学方程式为
。
(4)F转化为D的化学方程式为
。
20.(14分)工业纯碱中常含有少量的NaCl杂质,实验室可利用下图装置来测定工业纯碱中Na2CO3的质量分数。图中:1.空气 3.纯碱 4.稀硫酸 6.碱石灰(固体和NaOH和生石灰的混合物)
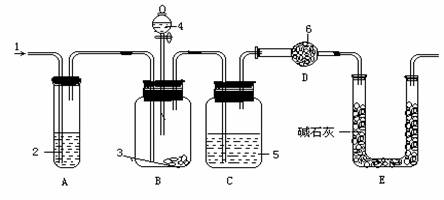 其步骤是:
其步骤是:
①组装好实验仪器,并检查其气密性。
②准确称量盛有碱石灰的干燥管D的质量(设为m1g)。
③准确称量一定量的工业纯碱(设为ng),并将其放进广口瓶内。
④从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止。
⑤准确称量干燥管D的总质量(设为m2g)。根据上述实验回答:
(1)装置C中试剂“5”是 ,如果撤去装置C,则会导致实验结果 (填“偏大”、“偏小”或“不变”)。

 (2)实验进行操作④时,要缓缓鼓入空气,其作用是 ,装置A中盛装的液体“2”应选用 ,装置A的作用是 。
(2)实验进行操作④时,要缓缓鼓入空气,其作用是 ,装置A中盛装的液体“2”应选用 ,装置A的作用是 。
(3)装置E的作用是 。

 (4)根据此实验,写出计算纯碱中Na2CO3质量分数的算式
。
(4)根据此实验,写出计算纯碱中Na2CO3质量分数的算式
。
19.(7分)用实验确定某酸HA是弱电解质,两同学的方案如下。
甲:①称取一定质量的HA配制0.1mol/L 的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量的浓度HA溶液,盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀溶液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)
 在两个方案中的第①步中,都要用到的定量仪器是
在两个方案中的第①步中,都要用到的定量仪器是
(2) 甲方案中,说明HA是弱电解质是测得溶液的pH 1(填“>”、“<”、“=”)。
 乙方案中,说明HA是弱电解质的现象是
。
乙方案中,说明HA是弱电解质的现象是
。
A.装HCl溶液的试管中放出 H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体速率一样快
(3) 请你评价乙方案中难以实现之处和不妥之处。
难以实现之处

不妥之处

(4)
 请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述。实验方案为
请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述。实验方案为

18.在常温时,将a1mLb1mol/LCH3COOH溶液加入到a2mLb2mol/LNaOH溶液中。下列结论中,不正确的是。
A.如果a1=a2 ,b1=b2则混合溶液中c(CH3COO--)=c(Na+)
B.如果混合溶液的pH=7则混合溶液中c(CH3COO--)=c(Na+)
C.如果混合溶液的pH<7,则a1b1=a2b2
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
第一学期
高三级化学科期中考试卷
17.已知Cl--、Fe2+、H2O2、I--、SO2均具有还原性,且在酸性溶液中的还原性依次增强。下列各反应不可能发生的是
A.2Fe2+ + Cl2 = 2Fe3+ + 2Cl--
B.2Fe3+ + SO2 + H2O = 2Fe2+ + SO42-- + 4H+
C.H2O2 + H2SO4 = SO2 + O2 + 2H2O
D.I2 + SO2 + 2H2O = H2SO4 + 2HI
16.工业废气中氨的氮化物是最主要的污染源,有一种治理污染的方法是通过适量氨气将氮的氧化物还原为无毒物质N2和H2O。现有氮的氧化物NO和NO2的混合气体3L,与同条件下的NH33.5L恰好完全反应,则混合气体中NO和NO2的体积之比是
A.1:1 B.1:2 C.1:3 D.1:4
15.5.6L(标准状况)CH4完全燃烧生成CO2和液态水,放出222.5kJ的热量,则其燃烧热是
A.222.5kJ/mol B.--222.5kJ/mol
C.890kJ/mol D.--890kJ/mol
14.化学反应C(s) + H2O(g)═CO + H2;△H > 0达到平衡时,下列叙述正确的是
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体碳,平衡向正反应方向移动
C.通入水蒸气,使容器内压强增大,平衡向逆反应方向移动
D.扩大容器的体积,平衡向正反应方向移动
13.等体积、等物质的量的浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中的有关离子浓度应满足的关系是
A.c (M+) > c (OH--) > c (A--) > c (H+)
B.c (M+) > c (A--) > c (H+) > c (OH+)
C.c (M+) > c (A--) > c (OH+) > c (H+)
D.c (M+) + c (H+) = c (A--) + c (OH+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com