
题目列表(包括答案和解析)
入选的试题主要按题型、内容和难度进行排列,选择题在前,非选择题在后,同一题型中同一学科的试题相对集中,同一学科中不同题目尽量按由易到难的顺序排列。
试卷包括容易题、中等难度题和难题,以中等难度题为主。
物理、化学、生物三科的内容比例约为40%,36%,24%。
试卷一般包括选择题和非选择题,其中非选择题包括填空题、实验题、作图题、计算题等题型。
(二)考试范围及要求
为了便于考查,将高考化学各部分知识内容要求的程度,由低到高分为三个层次:了解,理解(掌握),综合应用。一般高层次的要求包含低层次的要求。其含义分别为:
了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题,即不仅“知其然”,还能“知其所以然”.
综合应用:在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题。
化学基础知识和基本技能主要包括:化学基本概念和基本理论、常见元素的单质及其重要化合物、有机化学基础、化学实验和化学计算五个方面。
化学基本概念和基本理论
l.物质的组成、性质和分类
(1)了解物质的分子、原子、离子、元素等概念的涵义;初步了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)了解同素异形体的概念。
(5)理解酸、碱、盐、氧化物的概念及其相互联系。
2.化学用语
(1)熟记并正确书写常见元素的名称、符号、离子符号。
(2)熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
(3)掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
(4)理解质量守恒定律的涵义。掌握热化学方程式的含义。能正确书写化学方程式、热化学方程式、电离方程式、离子方程式、电极反应式。
3.化学中常用计量
(1)了解相对原子质量、相对分子质量的涵义。
(2)了解物质的量的单位--摩尔(mol),摩尔质量(g·mol-1 )、气体摩尔体积(L·mol-1)。理解物质的量浓度(mol·L-1)、阿伏加德罗常数。掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
4.化学反应与能量
(1)掌握化学反应的四种基本类型:化合、分解、置换、复分解。
(2)理解氧化还应反应,了解氧化剂和还原剂等概念。掌握重要氧化剂、还原剂之间的常见反应。能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
(3)了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热、中和热等概念。初步了解新能源的开发。
5.溶液
(1)了解溶液的含义。
(2)了解溶液的组成,理解溶液中溶质的质量分数的概念。
(3)了解饱和溶液、不饱和溶液的概念。了解溶解度的概念。了解温度对溶解度的影响及溶解度曲线。
(4)初步了解结晶、结晶水、结晶水合物、风化、潮解的概念。
(5)了解胶体的概念及其重要性质和应用。
6.物质结构
(1)了解原子的组成及同位素的概念。理解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
(2)以第1、2、3周期的元素为例,了解原子核外电子排布规律。
(3)理解离子键、共价键的含义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力。初步了解氢键。
(4)了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
7.元素周期律和周期表
(1)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。
(2)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以IA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
8.化学反应速率、化学平衡
(1)了解化学反应速率的概念,反应速率的表示方法.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
(2)了解化学反应的可逆性。理解化学平衡的含义及其与反应速率之间的内在联系。
(3)理解勒夏特列原理的含义。理解浓度、温度、压强等条件对化学平衡移动的影响。
(4)以合成氨工业生产为例,用化学反应速率和化学平衡的观点理解工业生产的条件。
9.电解质溶液
(1)了解电解质和非电解质、强电解质和弱电解质的概念。
(2)理解离子反应的概念。
(3)理解电解质的电离平衡概念。
(4)了解水的电离、溶液pH等概念。
(5)了解强酸强碱中和滴定的原理。
(6)理解盐类水解的原理。了解盐溶液的酸碱性。
(7)理解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
(8)理解电解原理。了解铜的电解精炼、镀铜、氯碱工业反应原理。
常见元素的单质及其重要化合物
了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型金属和典型非金属在周期表中的位置及与其性质的关系。了解其他常见金属和非金属元素的单质及其化合物。
1.IA和ⅡA族元素--典型的金属
(1)了解金属钠的物理性质,掌握钠和镁化学性质。
(2)从原子的核外电子排布,理解IA、ⅡA族元素(单质、化合物)的相似性和递变性。
(3)以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
2.卤族元素--典型的非金属
(1)以氯为例,了解卤族元素的物理性质和化学性质。
(2)从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。
(3)掌握氯气的化学性质,了解几种重要的含卤素化合物的性质和用途。
3.其他常见的非金属元素(如:H、O、S、N、P、C、Si)
(1)了解这些元素的单质及某些氧化物、氢化物的性质。
(2)以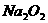 为例,了解过氧化物的性质。
为例,了解过氧化物的性质。
(3)掌握硫酸、硝酸的化学性质。
(4)以硫酸为例,了解化工生产化学反应原理的确定。初步了解原料与能源的合理利用、“三废处理”与环境保护以及生产过程中的综合经济效益问题。
(5)了解常见盐类的性质和用途。
(6)初步了解常见化肥的基本性质。
(7)了解硫、氮、碳的氧化物对大气的污染及其防治。
(8)初步了解氟氯烃、含磷洗涤剂及粉尘对环境及人类健康的影响。
(9)初步了解生活用水的净化及污水处理的基本原理。
4.其他常见的金属(如:Fe、Al)
(1)了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。
(2)掌握Fe和Al的化学性质。
(3)了解常见金属的活动顺序。
(4)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性。
(5)了解铝的重要化合物。
(6)初步了解合金的概念。
5.了解在生活和生产中常见的无机化合物的性质和用途。
6.以上各部分知识的综合应用。
有机化学基础
1.了解有机化合物数目众多和异构现象普遍存在的本质原因。
2.理解基团、官能团、同分异构体、同系物等概念。能够识别结构式(结构简式)中各种原子的连接次序和方式、基团和官能团。能够辩认同系物和列举异构体。了解烷烃的命名原则。
3.以一些典型的烃类化合物为例,了解有机化合物的基本碳架结构。掌握各类烃(烷烃、烯烃、炔烃、芳香炔)中各种碳碳键、碳氢键的性质和主要化学反应。
4.以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油脂、多羟基醛酮、氨基酸等)为例,了解官能团在化合物中的作用。掌握各主要官能团的性质和主要化学反应。
5.了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。
6.了解在生活和生产中常见有机物的性质和用途。
7.以葡萄糖为例,了解糖类的基本组成和结构,主要性质和用途。
8.了解蛋白质的基本组成和结构,主要性质和用途。
9.初步了解重要合成材料的主要品种的主要性质和用途。理解由单体通过聚合反应生成离子化合物的简单原理。
10.通过上述各类化合物的化学反应,掌握有机反应的主要类型。
11.综合应用各类化合物的不同性质,进行区别、鉴定、分离、提纯或推导未知物的结构简式。组合多个化合物的化学反应,合成具有指定结构简式的产物。
化学实验
1.了解化学实验常用仪器的主要用途和使用方法。
2.能绘制和识别典型的实验仪器装置图。
3.掌握化学实验的基本操作。了解实验室一般事故的预防和处理方法。
4.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
5.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别。
6.根据实验现象,观察、记录、分析或处理数据,得出正确结论。
7.根据实验试题要求,设计或评价实验方案。
8.以上各部分知识与技能的综合应用。
化学计算
1.掌握有关相对原子质量、相对分子质量及确定分子式的计算。
2.掌握有关物质的量的计算。
3.掌握有关气体摩尔体积的计算。
4.掌握有关溶液浓度(溶液中溶质的质量分数和物质的量浓度)的计算。
5.掌握利用化学反应方程式的计算。
6. 掌握有关溶液pH与氢离子浓度、氢氧根离子浓度的简单计算。
7. 掌握有关燃烧热的简单计算。
8. 以上各类化学计算的综合应用。
Ⅲ.命题指导思想
以能力测试为主导,考查考生对所学相关课程基础知识、基本技能的掌握程度和综合运用所学知识分析、解决实际问题的能力。
试题要重视理论联系实际,关注科学技术、社会经济和生态环境的协调发展;要重视对考生科学素养的考查。
Ⅳ.考试形式及试卷结构
1 .观察能力
能够通过对实验现象、实物、模型、图形、图表以及自然界、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆的能力。
2 .实验能力
( 1 )用正确的化学实验基本操作,完成规定的“学生实验”的能力。
( 2 )观察记录实验现象,处理实验数据和分析实验结果,得出正确结论的能力。
( 3 )初步处理实验过程中的有关安全问题的能力。
( 4 )能识别和绘制典型的实验仪器装置图的能力。
( 5 )根据实验试题的要求,设计或评价简单实验方案的能力。
3 .思维能力
( 1 )对中学化学应该掌握的内容能融会贯通。将知识点统摄整理,使之网络化,有序地存储,有正确复述、再现、辨认的能力。
( 2 )能将化学问题分解,找出解答的关键。能够运用自己存储的知识,将它们分解、迁移转换、重组,使问题得到解决的应用能力。
( 3 )能将化学信息(含实际事物、实验现象、数据和各种信息、提示、暗示),按题设情境抽象归纳,逻辑地统摄成规律,并能运用此规律,进行推理(收敛和发散)的创造能力。
( 4 ) 通过分析和综合、比较和论证,对解决问题的方案进行选择和评价的能力。
( 5 ) 将化学问题抽象成为数学问题,利用数学工具,通过计算和推理(结合化学知识),解决化学问题的能力。
4.自学能力
(1)敏捷地接受试题所给出的新信息的能力。
(2)将试题所给的新信息,与课内已学过的有关知识结合起来,解决问题的能力。
(3)在分析评价的基础上,应用新信息的能力。
这四种能力范畴,事实上是有重叠交叉的。一个试题可以测试多种能力或是一种能力中的多个层次。
15、下列有关阿伏加德罗常数的叙述正确的是
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO-
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为
答案:1AC 2BC 3CD 4BC 5B 6AD 7D 8BC 9C 10D 11D 12D 13BC 14BC 15A
14、下列有关阿伏加德罗常数的叙述正确的是
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键
13、下列有关阿伏加德罗常数的叙述正确的是
(A)17g OH-含有9×6.02×1023个电子
(B)标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
(C)106g碳酸钠固体中含有6.02×1023个阴离子
(D)标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
12、NA代表阿伏加德罗常数值,下列说法正确的是
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com