
题目列表(包括答案和解析)
26.下图转化过程中A、B、C为中学化学常见元素的化合物,甲、乙、丙为单质。
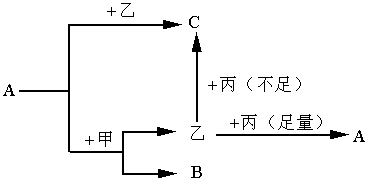
(1)若甲作还原剂,C的化学式为 ;A与甲的反应方程式为 。
(2)若甲作氧化剂,且都在溶液中进行的反应,则C的化学式为 。当A 与甲的物质的量之比为1∶1,则A与甲发生反应的离子方程式为 。
25.1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2, 恰好使气体完全溶于水中,则通入O2的体积是( )
(A)504mL (B)168mL (C)336mL (D)224mL
24.金属钠能溶解在液氨中形成蓝色的溶液,有人认为蓝色是生成了电子的氨合物e(NH?3)-n所致,此反应可写作Na+nNH3=Na++e(NH3)-n。小心蒸发蓝色溶液,可发生下列反应:Na+2NH3=NaNH2+H2,NaNH2是白色的固体物质。以下叙述中不正确的是( )
(A)NaNH2在液氨中不能电离
(B)钠溶于液氨形成的溶液是强还原剂
(C)蒸发蓝色溶液时蓝色会逐渐褪去
(D)蒸发过程中液氨被氧化为H2
23.在一定条件下,萘可被浓硫酸、浓硝酸的混合酸硝化,生成二硝基化合物--1,5-二硝基萘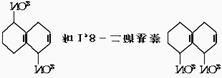 的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。
的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。
将这两种硝化产物加入适量的98%硫酸中,充分搅拌,用耐酸漏斗过滤。要从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
(A)蒸发浓缩晶体
(B)向滤液中加水后过滤
(C)用Na2CO3溶液处理滤液
(D)将滤液缓缓加入水中
22.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示成
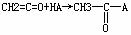 。乙烯酮在一定条件下与下列各试剂发生加成反应时所得产物不正确的是( )
。乙烯酮在一定条件下与下列各试剂发生加成反应时所得产物不正确的是( )
(A)与HCl加成时得CH3COCl
(B)与H2O加成时得CH3COOH
(C)与CH3OH加成时得CH3COCH2OH
(D)与CH3COOH加成时得
21.有一铁的氧化物样品,用140mL5mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为( )
(A)Fe4O5 (B)Fe5O7
(C)Fe2O3 (D)Fe3O4
20.某结晶水合物的化学式为R·nH2O,其式量为M。25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液。下列关系中正确的是( )
(A)饱和溶液的物质的量浓度为c=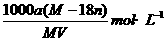
(B)饱和溶液中溶质的质量分数为W=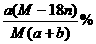
(C)25℃时R的溶解度为S=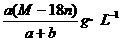
(D)饱和溶液的密度为ρ=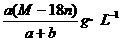
19.将KCl和CrCl3两种固体混合、熔烧,可制得化合物X。将1.892gX中的铬元素氧化为Cr2O2-7,则Cr2O2-7可从过量的KI溶液中氧化出2.667g单质碘,反应的 离子方程式为Cr2O2-7+6I-+14H+=2Cr3++3I2+7H2O。现取溶有1. 82 9gX溶液,向其中加入过量的硝酸银溶液,可得4.52g白色沉淀。表示X组成的化学式为( )
(A)K2Cr2Cl7 (B)K3Cr2=Cl5
(C)K3Cr2Cl9 (D)K3Cr2Cl4
18.有X、Y、Z三种盐。已知(1)25℃时,X的饱和溶液中X的质量分数为15%;(2)25℃时,向100g质量分数为10%的Y的溶液中加入5gY的无水盐,可恰好达到饱和;(3)25℃时,从一定量的Z溶液中蒸发掉5.75g水,再恢复至25℃,或保持在25℃时向其中加入6.3gZ的结晶水合物( Z·9H2O,其式量为240),都可恰好形成饱和溶液。25℃,X、Y、Z(均指不含结晶水的盐) 的溶液解度由大到小的顺序为( )
(A)X>Y>Z (B)Z>Y>X
(C)Z>X>Y (D)Y>Z>X
17.某酸式盐NaHY在水溶液中HY-的电离度小于HY-的水解程度。与此有关的以下叙述中正确的是( )
(A)H2Y的电离方程式为H2Y+H2O HY-+H3O+
HY-+H3O+
(B)在NaHY的水溶液中各离子浓度间的关系为[Na+]>[Y2-]>[HY-]>[H+]
(C)在NaHY的水溶液中各离子浓度间的关系为[Na+]>[HY-]>[OH-]>[H+]
(D)HY-的水解方程式为HY-+H2O H3O++Y2-
H3O++Y2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com