
题目列表(包括答案和解析)
21(14分)、A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2:A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性:B与D可形成一种极易溶于水的气体X,B与C可能形成极易溶于水的气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的电子相等,请回答:
(1)写出四种元素的符号:A________ B________ C________ D________
(2)写出下列反应的化学方程式:
①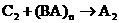 :________________________________
:________________________________
②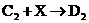 :________________________________
:________________________________
(3)B4A3D2的化学式为___________,其水溶液显酸性的离子方程式为_________________________________。
 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
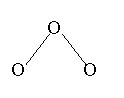 22(11分)、1994年度诺贝尔化学奖授予为研究O3作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图:
22(11分)、1994年度诺贝尔化学奖授予为研究O3作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图:
呈V型,键角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键---三个O原子均等地享有这个四个电子。请回答:
(1)臭氧与氧气的关系是 。
(2)下列分子与臭氧分子结构最相似的是 ( )
A、H2O B、CO2 C、SO2 D、BeCl2
(3)分子中某原子有一对没有跟其它原子共用的价电子叫孤对电子,那么臭氧分子中有 对孤对电子。
(4)臭氧分子是否为极性分子 (是或否)
(5)O3与O2间的转化是否为氧化还原反应?(若否,请回答A小题;若是,请回答B小题)
A、 O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平
PbS+ O3 -- PbSO4 + O2
B、O3在催化剂作用下生成1molO2转移电子数为 mol
23(9分)、(1)常温下,高锰酸钾跟浓盐酸反应,可生成氯气,同时MnO4-被还原成Mn2+。写出这一氧化还原反应的离子方程式 。
(2)将H2S跟浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是H2SO4, HNO3的还原产物是NO,生成物中还有水,写出这一反应的化学方程式 。
如反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是 L,这些NO全部被氧化为NO2,需O2的体积为 L(标准状况)。
(3)已知 H2O(l)==H2O(g); △H==44.0kJ/mol,2.2g丙烷完全燃烧生成CO2及液态水放出111kJ的热量,试写出丙烷燃烧生成CO2和水蒸气的热化学方程式 。
24(8分 )、下面是9种化合物的转变关系
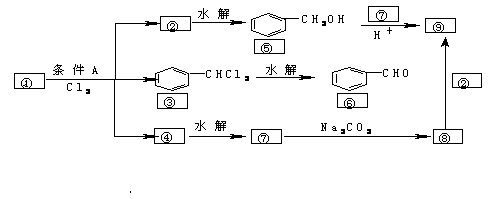
通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
= C-OH → >C=O +H2O
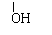
(1)化合物①是_________,它跟氯气发生反应的条件A是______。
(2)化合物⑤跟⑦可在酸的催化作用下去水生成化合物⑨,⑨的结构简式是______,名称是__________。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它,此反应的化学反应方程式是____________。
19(12分)、某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
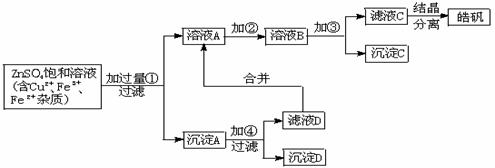
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,
其目的是 。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
(3)加入的试剂③是
的目的是 。
20、(10分)实验室配制500 mL 0.5 mol·L-1的NaC1溶液,有如下操作步骤:
①把称量好的NaC1晶体放入小烧怀中,加适量蒸馏水溶解;②把①所得溶液小心转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度1 cm - 2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)操作步骤的正确顺序为_ _ (填序号)。
(2)本实验用到的基本实验仪器有 。
(3)某同学俯视容量瓶刻度线滴加蒸馏水而定容,对所配溶液浓度有何影响?________(“偏高”“偏低”或“无影响”)。
(4)若出现如下情况,对所配溶液浓度将有何影响:
没有进行操作步骤④________;加蒸馏水时不慎超过了刻度________。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度 。
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面
18、9.8g铁镁混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到0.2molNO气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量可能为 ( )
A、18g B、20g C、22g D、24g
选择题答案:
第Ⅱ卷(非选择题 共78分)
17、在一个固定容积的密闭容器中加入2mol A和1mol B,发生反应:
2A(g) + B(g) 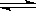 3C(g) + D(g)达到平衡时,C的浓度为w mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
( )
3C(g) + D(g)达到平衡时,C的浓度为w mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
( )
A、4mol A + 2mol B B、3mol C + 1mol D
C、2mol A+1molB+3molC+1molD D、1molA+0.5molB+1.5molC+0.5molD
16、为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=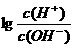 ,则下列叙述正确的是
( )
,则下列叙述正确的是
( )
A、中性溶液的AG=0 B、酸性溶液的AG<0
C、常温下0.1mol/LNaOH溶液的AG=12 D、常温下0.1mol/L盐酸溶液的AG=12
15、下列画有横线的物质在反应中不能完全消耗的是 ( )
A.将含少量H2O(g)的H2通入盛有足量Na2O2的容器中并不断用电火花点燃
B.将l mol Cu置于含2 mo1H2SO4的浓硫酸中加热
C.在强光持续照射下,向过量的Ca(C1O)2溶液中通入少量的CO2
D.在一定条件下,3体积H2和1体积N2在催化剂存在下反应
14、我国首创的铝-空气-海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是 ( )
① Fe-2e-===Fe2+ ②Al-3e- ===A13+ ③O2+2H2O+4e- ===4OH-
④4Al+3O2+6H2O===4Al(OH)3 ⑤2Fe+O2+2H2O===2Fe(OH)2
A.②③④ B.①③⑤ C.①⑤ D.③④
13、.已知A2O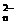 可与B2-反应,B2-被氧化,产物为B单质,A2O
可与B2-反应,B2-被氧化,产物为B单质,A2O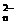 被还原,产物为A3+,且知100 mL c(A2O
被还原,产物为A3+,且知100 mL c(A2O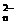 )=0.3mol·L-1的溶液与150 mL c(B2-)=0.6mol·L-1的溶液恰好完全反应,则n值为 ( )
)=0.3mol·L-1的溶液与150 mL c(B2-)=0.6mol·L-1的溶液恰好完全反应,则n值为 ( )
A.4 B.5 C.6 D.7
12、已知甲、乙溶质质量分数与密度的关系如下表:
|
溶质质量分数 |
甲溶液密度(g/cm3) |
乙溶液密度(g/cm3) |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
10% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是 ( )
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
11、1999年曾报道合成和分离了含高能量的正离子N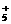 的化合物N5AsF6,下列叙述中错误的是
(
)
的化合物N5AsF6,下列叙述中错误的是
(
)
A.N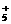 共有34个核外电子 B.N
共有34个核外电子 B.N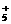 中氮-氮原子间以共用电子对结合
中氮-氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F的化合价为-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com