
题目列表(包括答案和解析)
26.(9分)向某二价金属M的氢氧化物的澄清溶液100mL中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25.0mL恰好与20.0mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)若欲计算M的相对原子质量,你认为还必须提供下列哪组数据 。(填代号)
A.M的氢氧化物溶液的浓度(设为2.00mol/L)
B.MCO3沉淀的质量(设为39.4g)
C.与MCO3反应的盐酸的浓度(设为1.00mol/L)
D.题设条件充足,不需补充数据
(2)根据你的选择,计算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量。(要有过程)
高三年级第一次阶段测试
25.(12分)(Ⅰ)恒温、恒压下,在一个可变容积的容器中发生如下反应:
 A(气)+B(气) C(气)
A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol.
(3)若开始时入xmolA和2molB,1molC到达平衡后,生成A和C的物质的量分别是ymol和3amol,则x= mol,y= mol,平衡时,B的物质的量 (选填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于,等于或小于2mol
作出判断的理由是
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
。
(Ⅱ)若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(Ⅰ)小题中的a行比较
(选填一个编号)。
(甲)a<b (乙)a>b
(丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是
24.(5分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题:
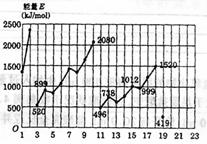
(1)同主族内不同元素的E值变化的特点是: ,各主族中E值的这种变化特点体现了元素性质的 变化规律;
(2)同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象。试预测下列关系中正确的是 (填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
<E<
(4)10号元素E值较大的原因是 。
23.(7分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它伞兵质量分别为mA、mB、mC,与足量盐酸反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl),已知mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl).请(1)写出短周期IA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为 。
(4)若A和B为ⅡA族元素的的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,nB:nC=1: 。(保留2位小数)
22.(5分)(1)配平下列离子反应方程式
Fe(OH)3+ ClO-+ OH- --→FeO4n-+ Cl-+ H2O
(2)已知有3.21gFe(OH)3参加反应,共转移了5.4×1022个电子,则n= ,FeO4n-中铁元素的化合价为 。
(3)根据①、②推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
21.(5分)燃料电池是燃料(如H2、CO、CH4、CH3OH等)跟氧气起反应将化学能转变为电能的装置,电解后溶液是强碱溶液,请写出甲醇燃料电池负极的电极反应式:
。
20.(6分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答:
(1)Na3N的电子式为 。
(2)Na3N与盐酸反应的化学方程式 。
(3)比较Na3N中两种微粒的半径 。
19.(6分)25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知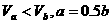 ,请填空白:
,请填空白:
(1)a值可否等于3(填“可”或“否”) ,理由是 。
(2)a值可否等于5(填“可”或“否”) ,理由是 。
(3)a的取值范围是 。
18.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的是 ( )
A.c(Na+)+c(H+) c(HCO3-)+c(CO32-)+c(OH-)
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
第Ⅱ卷(主观题 共55分)
17.具有相同电子层结构的三种粒子、An+、Bn-、C,下列分析正确的是 ( )
A.原子序数比较C>B>A
B.粒子半径比较Bn->An+
C.C一定是稀有气体元素的原子
D.原子半径比较A<C<B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com