
题目列表(包括答案和解析)
1.以下关于金属钠的叙述中正确的是( )
A.金属钠可保存在煤油中
B.金属钠可将铁从其溶液中转换出来
C.钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为放热反应
D.钠在空气中能发生缓慢氧化而发生自然
11.(宿迁二月考)(8分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
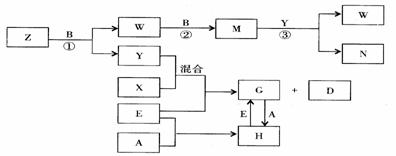
回答下列问题:
⑴ A的化学式为_______________;
⑵ 写出反应③的化学反应方程式________________________________;
⑶ Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_________________________;
⑷ 将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×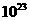 ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
⑸ 将Z与N反应后的产物溶于水中,则常温该溶液的pH_____7,其原因是(用离子方程式表示)___________________________________________。
(宿迁二月考答案)(8分)⑴ 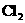 (1分) ⑵ 3NO2+H2O==2HNO3+NO;(2分)
(1分) ⑵ 3NO2+H2O==2HNO3+NO;(2分)
|
 ;(2分)
;(2分)
⑷ 14(1分) ⑸ <(1分)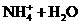

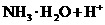 (1分)
(1分)
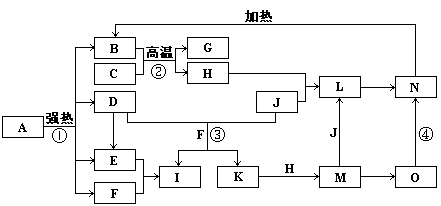
10.(盐城3月考)下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
请按要求回答:
(1) 写出L的化学式 ;
(2) 写出:反应③的离子方程式 ;
反应④的化学方程式 ;
(3) 反应②在工业生产上的用途是 ;
(4) 反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
(盐城3月考答案)(10分。每空2分)⑴ FeCl3
⑵ SO2+Cl2+2H2O=4H++SO42-+2Cl-
4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑶ 焊接钢轨(或冶炼钒、铬、锰等金属)
⑷ 2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
9.(06潍坊一考)(14分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
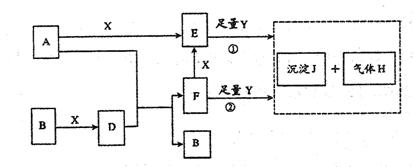
(1)化学式:B为___________,F为_____________;
(2)写出D的电子式___________,液态D能否导电_______________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)_______________;
a.直接与氧气发生化学腐蚀
b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:______________________________________________________;
(4)已知H的密度约是空气密度的1.1倍,则①中所涉及的反应的化学方程式为:
__________________________________,_______________________________。
(06潍坊一考答案)(1)H2 FeCl2
(2) 否
(3)b Fe-2e-=Fe2+
(4)2Na2O2+2H2O=4NaOH+O2↑ FeCl3+3NaOH=Fe(OH)3↓+3NaCl
8.(06南通密卷八)(11分)现有下列反应关系:
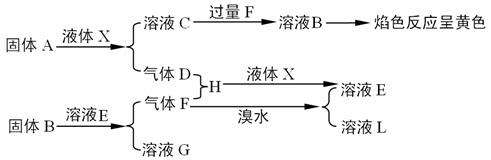
回答下列问题:
⑴固体A的电子式是 ;
⑵溶液C与过量F反应生成溶液B的化学方程式: ;
⑶气体F通入溴水的离子方程式: ;
⑷每有32gF与足量的D反应生成气态H时,就要放出25.5KJ的热量,写出表示该反应的热化学方程式: 。
(06南通密卷八答案)⑴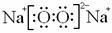 (2分)
(2分)
⑵ NaOH+SO2==NaHSO3 (3分)
⑶SO2+Br2+2H2O==4H++SO42-+ 2Br- (3分)
⑷2SO2(g)+O2(g) 2SO3(g)
ΔH = -98kJ/mol (3分)
2SO3(g)
ΔH = -98kJ/mol (3分)
7.(06南通密卷七)(10分)如图所示:

其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体,Y是一种难溶于水的白色固体,其相对分子质量是100。
请填空:
⑴D的电子式是_____________________。
⑵A跟D反应的化学方程式是________________________________________;该反应的反应热△H________0(填“<”、“>”或“=”)。
⑶在高温条件下,G跟J反应的化学方程式为________________________________。
(06南通密卷七答案)⑴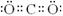 (2分)
(2分)
⑵2Mg+CO2 2MgO+C (3分) < (2分)
2MgO+C (3分) < (2分)
⑶CaO+3C CaC2+CO↑ (3分)
CaC2+CO↑ (3分)
6.(06南通密卷六)(10分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B________,D________。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式__________________。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式______________________________________。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为____________________________________________。
(06南通密卷六答案)(10分 每空2分)(1)F Mg
(2)2Na2O2+2CO2=4NaOH+O2
(3)2F2+2NaOH=2NaF+OF2+H2O
(4)c(Na+)>c(F-)>c(OH-)>c(H+)
5.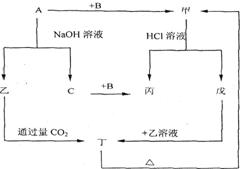 (06南通密卷五)(10分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。请回答:
(06南通密卷五)(10分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。请回答:
(1)写出下列物质的化学式:
A____________乙____________。
(2)写出甲物质在工业上的任两种主要用途
_______________________________________。
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式 ______________________________。
②乙与过量CO2反应的离子方程式 _________________________。
③戊溶液与乙溶液混合的离子方程式 _______________________________。
(06南通密卷五答案)(1) A-Al 乙-NaAlO2
(2) 耐高温材料、轴承 制取铝单质
(3)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
③Al3++3AlO2-+6H2O=4Al(OH)3↓
4.(06南通密卷四)(10分)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。
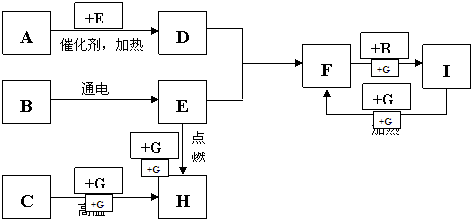
请按要求填空:
(1)写出下列物质的化学式:A B C 。
(2)写出A→D的化学方程式 。
(3)写出G和I的浓溶液反应的化学方程式 。
(06南通密卷四答案)(10分)NH3 H2O CO2 (各2分)
(2)4NH3+5O2  4NO+6H2O(2分)
4NO+6H2O(2分)
(3)C +4 HNO3(浓) CO2↑+ 4NO2↑+ 2H2O(2分)
CO2↑+ 4NO2↑+ 2H2O(2分)
3.(06南通密卷三)(12分)⑴某温度时,在一个真空容器中放入3 L的A和1 L的B,充分反应后,建立如下平衡:3A(g)+B(g) xC(g)+yD(g)。平衡时测得混合气体中D的质量分数为n%,如果现在把0.6 L的A、0.2 L的B、0.8 L的C和1.6 L的D气体在相同温度下放入相同的真空容器中,当反应也达平衡时,测得混合气体中D的质量分数也是n%,则化学反应方程式中x是 ,y是 。
xC(g)+yD(g)。平衡时测得混合气体中D的质量分数为n%,如果现在把0.6 L的A、0.2 L的B、0.8 L的C和1.6 L的D气体在相同温度下放入相同的真空容器中,当反应也达平衡时,测得混合气体中D的质量分数也是n%,则化学反应方程式中x是 ,y是 。
⑵室温下为液态的金属是 (填汉字名称)。电解它的一价金属的硝酸盐溶液时,阴极得到的产物是该金属的单质。当阴极消耗2 mol该盐的阳离子时,阳极可得1 mol的气体产物,则此气体的产物是 (填分子式)。由此可推断得知该盐的化学式 是 。其阴极上所发生的还原反应方程式是: 。
(06南通密卷三答案)⑴1 2 ⑵汞 O2 Hg2(NO3)2 Hg22++2e-=2Hg
(每空2分,共12分。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com