
题目列表(包括答案和解析)
10.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.K+、Ba2+、OH-、SO42- B.Ag+、NO3-、Cl-、K+
C.H3O+、NO3-、Fe2+、Na+ D.Cu2+、NH4+、Br-、OH-
9.2002年十大科技新闻之一是在世界各地9个研究所39名科学家通力合作下,欧洲核子研究中心成功地制造出约5万个低能量状态的反氢原子。已知反物质的主要特征是电子带正电荷,质子带负电荷。则以下可表示反物质酸与反物质碱进行中和反应实质的离子方程式是
A.H- +OH+====H2O B.H-+OH-====H2O
C.H+ +OH-====H2O D.H++OH+====H2O
8.能够用键能的大小作为主要依据来解释的是
A.常温常压下氯单质与溴单质的状态不同
B.氯化钠的熔点比碘化钠高
C.稀有气体一般难于发生化学反应
D.钠的密度比钾大
7.已知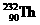 (钍)原子可发生下列放射性衰变:
(钍)原子可发生下列放射性衰变: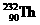
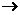
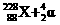 ,生成的元素与Fr(钫)处于同一周期,以下关于X的推断中错误的是
,生成的元素与Fr(钫)处于同一周期,以下关于X的推断中错误的是
A.X的氢氧化物是一种强碱 B.X的碳酸正盐不溶于水
C.X的原子核外有6个电子层 D.X的最高化合价为+2价
6.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子
C.2g重氧水(2H218O)含有NA个中子
D.84gNaHC03晶体中含有NA个CO32-
5.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF B.H3O+ C.NaH D.H2O2
4.下列溶液经反应后,溶液内含有0.50 mol NaHCO3和0.50 mol Na2CO3的是
A.0.50L 1.00 mol·L-1NaHCO3加0.50L 0.50 mol·L-1NaOH
B.0.50L 0.75 mol·L-1 Na2CO3加0.50L 0.50 mol·L-1 HCl
C.0.50L 1.00 mol·L-1 NaHCO3 加0.50L 0.25 mol·L-1 NaOH
D.1.00L 1.00 mol·L-1 Na2CO3 加1.00L 0.50 mol·L-1 HCl
3.下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.SO3 + H2O == H2SO4 B.2Na2O2 + 2H2O == 4NaOH +O2↑
C.2F2 + 2H2O == 4HF + O2 D.2Na + 2H2O == 2NaOH +H2↑
2..在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
1.下列电子式中错误的是
A.Na+ B.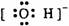 C.
C.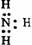 D.
D.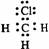
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com