
题目列表(包括答案和解析)
6、由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
5、在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
4、标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
3、设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
2、设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
1、依照阿伏加德罗定律,下列叙述正确的是 ( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。 B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。 D.同温同体积下两种气体的物质的量之比等于压强之比。
1、为了加强对考生思维品质、适应性、科学性、深刻性的考查,命题者往往有意设置一些陷阱,增大试题的区分度,陷阱的设置主要有以下几个方面:
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。
④氧化-还原反应:考查指定物质参加氧化-还原反应时,常设置氧化-还原反应中氧化剂、还原剂、氧化产物、还原产物被氧化、被还原、电子转移(得失)数目方面的陷阱。
⑤电离、水解:考查电解质溶液中微粒数目或浓度时常涉及弱电解质的电离,盐类水解方面的陷阱。
2.理解阿伏加德罗常数的涵义。了解阿伏加德罗常数的测定。了解气体摩尔体积的涵义。
[经典题型]
题型一:质量守恒定律的直接应用
[例1]2.1克相对分子质量为7.2的CO和H2组成的混合气体,在足量的O2中充分燃烧
后,立即通入盛有足量的Na2O2固体中,求固体增加的质量。
[点拨]根据常规的解法需要先求出CO和H2的质量,再求出CO和H2燃烧生成的CO2和H2O的质量,最后根据CO2和H2O分别与Na2O2的反应求出固体增加的质量。
如果根据质量守恒求解则十分简单。因为固体Na2O2→Na2CO3,固体增加的质量可看作CO的质量,固体Na2O2→2NaOH, 固体增加的质量可看作H2的质量,所以固体增加的质量相当于CO和H2的质量,即为2.1克。
[规律总结]内容:参加化学反应的物质的质量总和等于反应后生成的物质的质量总和。
实质:化学反应前后元素的种类和原子的个数不发生改变。
[例2]在一定条件下,16gA和22gB恰好反应生成C和4.5gD。在相同条件下,8gA和15gB反应可生成D和0.125molC。从上述事实可推知C的式量为____________。
[点拨]根据质量守恒定律,当16gA与22gB恰好反应生成4.5gD的同时,生成C的质量应为16+22-4.5=33.5g,当8gA和15gB反应时,根据判断B是过量的,A与C的质量关系应是16:33.5=8:x,x=16.75g,MC=16.75g/0.125mol=134g/mol,即C的式量为134。
题型二:阿伏加德罗常数的直接应用
[例3]下列说法正确的是(NA表示阿伏加德罗常数) ( )
⑴常温常压下,1mol氮气含有NA个氮分子
⑵标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为NA个
⑶标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个
⑷将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4L
⑸常温下,18g重水所含中子数为10NA个
⑹常温常压下,1mol氦气含有的核外电子数为4NA
⑺常温常压下,任何金属和酸反应,若生成2g 氢气,则有2NA电子发生转移
⑻标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
⑼31g白磷分子中,含有的共价单键数目是NA个
⑽1L1 mol•L-1的氯化铁溶液中铁离子的数目为NA
[点拨]⑴正确,1mol氮气的分子数与是否标准状况无关。
⑵正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有NA个分子。
⑶不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
⑷不正确,因为存在以下平衡:2NO2
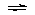 N2O4(放热),降温,平衡正向移动,分子数
N2O4(放热),降温,平衡正向移动,分子数
少于1mol,标准状况下,其体积小于22.4L
⑸不正确,重水分子(D2O)中含有10个中子,相对分子质量为 20,18g重水所含中子数为:10×18g/20g· mol-1=9mol。
⑹正确,1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol
电子,这与外界温度和压强无关。
⑺正确,不论在任何条件下,2g氢气都是1mol,无论什么金属生成氢气的反应均可表示为:2H++2e=H2↑,因此,生成1mol氢气一定转移 2mol电子。
⑻不正确,标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol。
⑼不正确,白磷分子的分子式为P4,其摩尔质量为124g/mol,31g白磷相当于0.25mol,
白磷的分子结构为正四面体,一个白磷分子中含有6个P-P共价键,所以,0.25mol白磷中含有1.5NA个P-P共价键。
⑽不正确,Fe3+在溶液中水解。
本题答案为⑴⑵⑹⑺
[练习1](2001春季高考题)氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是 ( )
A.35Cl原子所含质子数为18
B.1/18 mol的1H35Cl分子所含中子数约为
C.3.5g的35Cl2气体的体积为2.24L
D.35Cl2气体的摩尔质量为70 g/mol
[点拨]该题以35Cl为背景,考查了35Cl原子所含质子数、1H35Cl分子所含中子数以及35Cl2气体的摩尔质量及摩尔体积等,其中1H是所有原子中唯一无中子的原子,“3.5g的35Cl2气体的体积为2.24L”中设置了状态未确定的陷阱。答案为B、D
[规律总结]
1.理解质量守恒定律的涵义。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com