
题目列表(包括答案和解析)
24、(1)减小 (2)不变 (3)不变 (4)增大
23、(1)向右,先变深再变浅 ;向左,变深
(2)不移动,变深; 向右,变深; 向左,变浅
22、(2)吸热 (3)bc (4)830
21、(1)小于 (2)逆反应 ,x小于3 (3)小于
20、0.022
27、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(气)+2B(气)  2C(气)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C(气)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(气)+E(气)  2F(气)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(设A、B、C和D、E、F之间均不发生反应)。
2F(气)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(设A、B、C和D、E、F之间均不发生反应)。
化学平衡移动原理及化学平衡常数练习
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
AC |
AD |
C |
D |
B |
C |
D |
AD |
B |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
B |
C |
C |
A |
C |
AD |
C |
C |
B |
26、下列反应在210℃达到平衡: ①
PCl5(气) PCl3(气)+Cl2(气)(正反应吸热) K=1 ②CO(气)+Cl2(气)
PCl3(气)+Cl2(气)(正反应吸热) K=1 ②CO(气)+Cl2(气) COCl2(气)(正反应放热) K=5×104 ③COCl2(气)
COCl2(气)(正反应放热) K=5×104 ③COCl2(气) CO(气)+ Cl2(气) (正反应吸热)
CO(气)+ Cl2(气) (正反应吸热)
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
(a)[PCl5]=[PCl3]=[Cl2]=1 (b) [PCl5]=[PCl3][Cl2]=1 (c) [PCl5]=[PCl3][Cl2]
反应②和反应③的K值表达式 (填“相同”或“不同”)
(2)降低Cl2浓度,反应③的K值 (填“增大”、“减少”或“不变”)
(3)要使反应①和反应②的K值相等,应采取的措施是
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c) 反应①降低温度, 反应②维持210℃
25、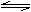 高炉炼铁中发生的基本反应之一如下:FeO(s) + CO(g) Fe(s) +CO2(g)(正反应为吸热反应),其平衡常数可表示为 K = c(CO2)/c(CO),已知1100℃时K = 0.263
高炉炼铁中发生的基本反应之一如下:FeO(s) + CO(g) Fe(s) +CO2(g)(正反应为吸热反应),其平衡常数可表示为 K = c(CO2)/c(CO),已知1100℃时K = 0.263
(1) 温度升高后达到新的平衡,高炉内CO2和CO的体积比值 ,平衡常数K值 。
(2) 1100℃时测得高炉内c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,在这种情况下,该反应是否处于化学平衡状态 ,此时化学反应速率是v(正) v(逆),其原因是 。
24、在一定条件下,N2O4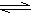 2NO2,△H>0可逆反应达到平衡,当分别改变下列条件时,填入N2O4分解率与原分解率的比较情况(增大、减小、不变)。
2NO2,△H>0可逆反应达到平衡,当分别改变下列条件时,填入N2O4分解率与原分解率的比较情况(增大、减小、不变)。
(1)保持容器容积不变,通入二氧化氮使体系压强增大一倍,则达到平衡时N2O4分解率________。
(2)保持容器容积不变,通入氖气使体系压强增大一倍,则达到平衡时N2O4分解率________。
(3)保持压强不变,通入二氧化氮使体系的容积增加一倍,则达到平衡时N2O4分解率________。
(4)保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时N2O4分解率________。
23、下列平衡体系均有颜色,改变条件后,平衡怎样移动?颜色如何变化?
 (1)2NO2(g) N2O4(g);△H=-57kJ/mol,迅速加压:平衡
,颜色 ;加热:平衡
,颜色 。
(1)2NO2(g) N2O4(g);△H=-57kJ/mol,迅速加压:平衡
,颜色 ;加热:平衡
,颜色 。
 (2)2HI(g)
H2(g)+I2(g);
△H>0 加压:平衡
,颜色
。
(2)2HI(g)
H2(g)+I2(g);
△H>0 加压:平衡
,颜色
。
加热:平衡 ,颜色 。 加H2:平衡 ,颜色 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com