
题目列表(包括答案和解析)
25、(14分)某化学研究学习小组的同学在做Na2O2与水反应时,向反应后的溶液滴加酚酞试液,溶液呈红色,但很快褪色。甲、乙、丙三同学分别对此现象做如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高而使红色褪去。
乙:因为加水的量较少,红色褪去可能是生成的NaOH浓度较大,即酚酞在高浓度的NaOH溶液不显红色。
丙:Na2O2与水反应(Na2O2不能存在于水中)后,溶液中可能存在强氧化性物质,它(们)氧化漂白了酚酞试液。
(1)验证甲同学的推测是否正确的方法是 。
(2)验证乙同学的推测是否正确的方法是 。
(3)当出现 现象时,即可说明丙同学的推测正确。
(4)有同学提出用定性方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法是 。

 (5)有同学提出用定量方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的
,理由是
。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(填“100mL”、“200mL”、“500mL”或“1000mL”。
(5)有同学提出用定量方法探究丙同学推测的溶液中可能存在强氧化性物质是H2O2的方法:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的
,理由是
。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(填“100mL”、“200mL”、“500mL”或“1000mL”。
24、 (6分)某学生采用不同试剂共进行了三组实验,每组步骤如下:
(6分)某学生采用不同试剂共进行了三组实验,每组步骤如下:
①用一支小试管取少量溶液A
②向A中通入过量气体X得到溶液B
③再在试管外套一只气球(气球内无气体,如图)
④加热试管得到液体C
⑤再冷却试管,又得到溶液B
试根据上述实验操作填写下表中有关内容。
|
|
溶液A名称 |
X分子式 |
溶液B颜色 |
液体C现象 |
|
Ⅰ组 |
澄清石灰水 |
CO2 |
① |
② |
|
Ⅱ组 |
③ |
④ |
无色 |
红色溶液 |
|
Ⅲ组 |
⑤ |
⑥ |
红色 |
溶液红色变浅 |
23、(4分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是 和 ; 和 。
22、(10分)图32-3所示:甲、乙为相互串联的两电解池.

图32-3
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极________极,电极材料是________,电极反应式为________,电解质溶液可以是________.
(2)乙池中Fe极电极反应式为___________________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色.
(3)若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为________.
(4)电解后,若乙池剩余溶液为400mL,则溶液的pH=________.
21、(4分)(1)向盛有乙二酸饱和溶液的试管中滴入少量用硫酸酸化的0.5%的KMnO4溶液,振荡发现紫红色消褪并有少量气泡出现。
写出该反应的离子方程式: 。
(2)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸生成SiO2和液态水。已知室温下10g甲硅烷自燃放出热量446kJ,
表示其燃烧热的热化学方程式为 。
20、下列叙述中正确的是 ( )
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
19、 已知AgCl能溶于氨水而生成[Ag(NH3)2]+。NH4Cl溶液和AgNO3溶液混合后再滴入NaOH溶液,溶液中沉淀量Y与NaOH溶液加入量的关系曲线不可能的是 ( )
已知AgCl能溶于氨水而生成[Ag(NH3)2]+。NH4Cl溶液和AgNO3溶液混合后再滴入NaOH溶液,溶液中沉淀量Y与NaOH溶液加入量的关系曲线不可能的是 ( )


 A. B. C. D.
A. B. C. D.
18、以铁为阳极,以铜为阴极,对足量的NaOH溶液进行电解。电解过程中慢慢通入O2,一段时间后得到2molFe(OH)3沉淀,此间共消耗的水的物质的量为 ( )
A.2mol B.4mol C.4.5mol D.5mol
17、石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原了中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图。则x值为 ( )
A.8 B.12 C.24 D.60

16、从中草药茵陈蒿中可提取一种利胆的有效成分,其结构简式如下:
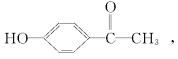 推测该药不可能具有的化学性质是 ( )
推测该药不可能具有的化学性质是 ( )
A.与氢氧化钠溶液反应 B.与碳酸氢钠溶液反应
C.与浓溴水反应 D.在一定条件下被还原成醇类物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com