
题目列表(包括答案和解析)
27.(11分) A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是________(选填“A”或“D”);A和B的离子中,半径较小的是________________(填离子符号)。
(2)元素C在元素周期表中的位置是________。
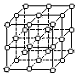
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是________。
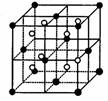

晶胞 晶胞的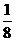
⑷分别写出A、B的电子排列式,C的轨道表示式:
A.________ B._________C._______
26.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
25、(12分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
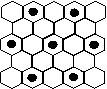
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
 ⑷右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有 个。
⑷右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl-离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有 个。
24、(12分)下面是四种盐在不同温度下的溶解度(g):
|
温度 |
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.8 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量比为1∶1的NaNO3和KCl为原料,加入一定量的水制取KNO3的实验,其流程如下框图所示。
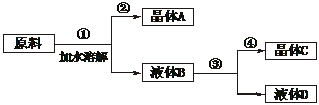
(1)在①和③的实验过程中,关键的实验条件是_________。
(2)分离出晶体的②和④两操作是_______(填倾倒、蒸发、结晶、过滤中的某种操作)。KNO3是晶体_______(A或C)。
(3)粗产品中可能含有的杂质离子是______,检验的方法是_____________________。
(4)将该粗产品提纯,可采取的方法是__________________。
23.(11分)将饱和三氯化铁溶液滴入沸水时,液体变为_______色,得到的是__________,反应的离子方程式为___________。用此分散系进行实验:
(1)将其装入U形管内,用石墨作电极,接通直接电源,通电一段时间后发现阴极附近颜色________,这表明________________________,这种现象称为_____________。
(2)向其中加入饱和的硫酸铵溶液,发生的现象是__________;原因是____________。
(3)向其中逐滴加入过量稀硫酸,现象是_________________;原因是_____________。
(4)提纯此分散系的方法叫_____________________。
22. (9分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
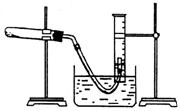
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag
②装好实验装置。 ③检查装置气密性。 ④加热,开始反应,直到产生一定量的气味。 ⑤停止加热(如图,导管出口高于液面)。 ⑥测量收集到气体和体积。 ⑦准确称量试管和残留物的质量为b g。 ⑧测量实验室的温度。 ⑨把残留物倒入指定容器中,洗净仪器,放回原处,把实验桌面收拾干净。 ⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量简内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同? 。
(4)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa).水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
21、(4分)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
⑴石蕊试纸(检验气体)_______________________________
⑵容量瓶____________________________________________
⑶酸式滴定管_______________________________________
⑷集气瓶(收集氯化氢):_____________________________
20. 2004年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录,该化合物的晶体结构单元是正六棱柱:镁原子在上下底面的各个棱角,而且上下底面各有一个镁原子;6个硼原子位于棱柱内,则该化合物的化学式可表示为
A. MgB B. MgB2 C. Mg2B D. Mg3B2
第II卷 (非选择题满分80分)
19. 下列说法不正确的是 ( )
A. 原子晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
B. H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键。
C. 乙醇与水互溶可以用相似相溶原理解释。
D. 甲烷可与水形成氢键这种化学键.
18. 下列关于丙烯(CH3-CH =CH2)的说法正确的( )
A. 丙烯分子有8个δ键,1 个∏键。B. 丙烯分子中3个碳原子都是sp3杂化。
C. 丙烯分子存在非极性键。 D. 丙烯分子中3个碳原子在同一直线上。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com