
题目列表(包括答案和解析)
26.(Ⅰ)下列实验操作或对实验事实的叙述正确的是 (填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
(Ⅱ)为了观察到铜与浓硝酸反应时的生成溶液颜色变化与产生气体颜色变化的实验现象,某学生改进了铜与浓硝酸反应的装置,设计了既方便操作、现象明显、符合环保要求的实验装置(右图)和实验方案:
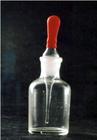 ⅰ.取一只无色滴瓶,内盛有适量的蒸馏水
ⅰ.取一只无色滴瓶,内盛有适量的蒸馏水
ⅱ.用镊子夹取适量铜丝于滴管中,套上橡皮滴管头
ⅲ.滴管吸取适量浓硝酸后,将滴管插入瓶中(管头下端浸入水中)。
回答以下实验现象和产生现象的原因:
(1)铜丝表面 ,滴管中溶液逐渐变为绿色,滴管
中液面上方产生 色气体;
反应方程式
(2)一段时间后滴管中的液面变化: ,原因 ;
滴瓶中溶液变为蓝色;
(3)一会儿滴管中液面变化: , 原因 ; 滴管中气体颜色 ,原因 ;
(4)反应后溶液的颜色由绿色变成蓝色,有同学提出溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。下面是他们验证结论的实验方案,其中正确的是 ( )
①加热绿色溶液,看是否有红棕色的气体产生。②加热绿色溶液,看溶液是否变蓝色。③在绿色溶液中加入蒸馏水稀释,看溶液是否从绿色变成蓝色。④在蓝色硝酸铜溶液中通二氧化氮气体,看是否变绿。⑤在绿色溶液中通人氧气,看是否变蓝。
A.①②③④ B.②④⑤ C.③④⑤ D.①②③④⑤
13.某氯化钠晶体是由Na+、35Cl-、和37Cl-组成.在熔融的条件下,用惰性电极使1mol这种氯化钠完全电解,阳极产生的气体质量为36.2g,则这种氯化钠晶体中35Cl-离子数约占氯离子总数的 ( )
A.25% B.40% C.50% D.75%
12.反应2A + B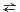 2C;△H<0,C是气态物质,反应达到平衡后,若同时升高温度并减小压强,又达到新平衡。若前后两次平衡C的百分含量相同,则下列判断正确的是( )
2C;△H<0,C是气态物质,反应达到平衡后,若同时升高温度并减小压强,又达到新平衡。若前后两次平衡C的百分含量相同,则下列判断正确的是( )
A.B不一定是气态物质 B.B一定是气态物质
C.B一定不是气态物质 D.A一定是气态物质
11.下列物质的水溶液能在蒸发皿中加热浓缩到原物质的是 ( )
①NaAlO2 ②FeCl3 ③明矾 ④绿矾 ⑤KNO3
⑥硝酸银 ⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2
A.①③⑤⑥⑧⑩ B.②③④⑤⑨⑩ C.③⑤⑦⑩ D.①③⑤⑩
9.在FeCl3和A1C13的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,最终所得的沉淀是 ( )
A.Fe(OH)3和Al(OH)3 B.FeS,A1(OH)3和S
C.A12S3和I2 D.Fe2S3和I2
|
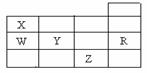 A.常压下五种元素的单质中,Z单质的沸点最高
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
8.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.K37ClO3与浓盐酸(HCl)在加热条件时生成氯气的化学方程式:
K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
B.在稀溶液中H+(ag)+OH-(ag)=H2O(l);△H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
|
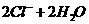

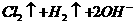
D.在氢氧化钡溶液中滴入硫酸氢钠溶液至中性:
Ba2+ + OH- + H+ + SO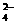
 BaSO4↓
+ H2O
BaSO4↓
+ H2O
7.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:
Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
6.2008年奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维下列说法正确的是( )
 A.羊毛与聚酯纤维的化学成分相同
A.羊毛与聚酯纤维的化学成分相同
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇
D.由单体合成聚酯纤维的反应属加聚反应
24、Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L硝酸恰好使混合物溶解,同时收到224mLNO气体(标准状况下)。
(1)Cu2O与稀硝酸反应的化学方程式为
__________________________________________________
(2)产物中硝酸铜的物质的量为____________。
(3)如混合物中含0.01mol Cu,则其中Cu2O和CuO的物质的量各为多少?
25硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
①计算吸收液中NaNO2和NaNO3物质的量之比。
②1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
高三化学第二次月考
23.纤维素是自然界最为丰富的可再生天然高分子资源。
⑴纤维素可制备用于造纸、纺织等的胶粘纤维[成分是(C6H10O5) n],生产过程涉及多个化学反应。工艺简图如下:

近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyacell纤维”成份也是(C6H10O5) n。工艺流程示意图如下:
① “Lyacell纤维”工艺流程中,可充分循环利用的物质是:_________________________。
② 与“Lyacell纤维”工艺相比,粘胶纤维工艺会产生含有______(只填非金属元素符号)的废物。并由此增加了生产成本。
③“Lyacell纤维”被誉为“21世纪的绿色纤维”,原因是:_________________________。

⑵“Lyacell纤维”工艺流程中的NMMO按以下合成路线制备(反应条件均省略):
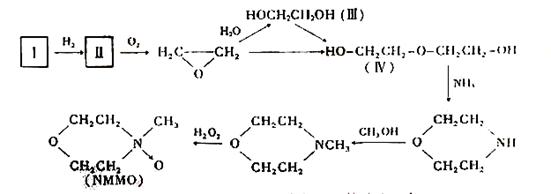
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
① 化合物Ⅰ也可聚合为在一定条件下能导电的高分子化合物,该高分子化合物的化学式为:_________________________。
② 化合物Ⅱ与O2反应的原子利用率达100%,其化学方程式为:_________。
③ 关于化合物Ⅲ、Ⅳ的说法正确的是:_________(填代号)
A.都可发生酯化反应 B.Ⅲ可被氧化,Ⅳ不可被氧化
C.都溶于水 D.Ⅲ可与钠反应,Ⅳ不可与钠反应
E.Ⅲ是乙醇的同系物 F.Ⅲ可由卤代烃的取代反应制备
④ 写出合成NMMO最后一步反应的化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com