
题目列表(包括答案和解析)
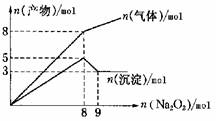
9.将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如上图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是
A..2mol、3mol、4mol B. 2mol、3mol、8mol C. 3mol、2mol、8mol D.3mol、2mol、4mol
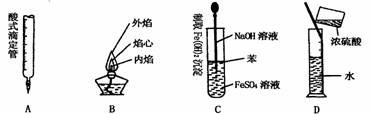
8. 下列对实验仪器名称的标注或实验操作,正确的是 c
下列对实验仪器名称的标注或实验操作,正确的是 c
7.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B. c(H+)+c(H2RO3) = c(RO32-)+c(OH-)
C. c(Na+)+c(H+) = c(HRO3-)+ c(RO32-)+c(OH-) D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
6.下列做法会导致食品对人体有害的是( )
①在沥青公路上翻晒粮食;②香肠中加过量亚硝酸钠以保持肉类新鲜;③用无烟煤直接烧烤鸡、鸭;④用“瘦肉精”喂养生猪;⑤用小苏打做发酵粉制面包;⑥用乙烯催熟水果。
A.①②③⑤ B.②③④⑤ C.①②③④ D.①②③④⑤
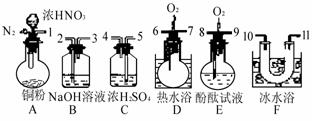
16.(历届12分) 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化温度:NO2为0.21℃,NO为-152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为 。
(2)反应前先通入N2目的是 。
(3)确认气体中含NO的现象是 。
(4)装置F的作用是 。
(5)如果O2过量,则装置B中发生反应的化学方程式为: 。
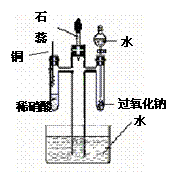 17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验
17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验
①检查装置气密性。
② 把中间四通直管中放入装有一定量水的水槽中,并向左右两侧试管及分液漏斗中加入图示试剂
③ 将铜丝插入稀硝酸,开始反应,一段时间后再铜丝从溶液中抽出。
④ 打开分液漏斗活塞,在试管中加入少量水,再立刻关闭。
⑤ 滴入几滴石蕊试液。
请你参与帮助解答以下问题
(1)步骤①中,如何检查该装置的气密性?
。
(2)步骤③中,当铜丝插入稀硝酸时,观察到的主要现象有:
。
(3)步骤④中,中间四通直管中,水面是否变化 (填:上升、下降、不变),写出此时变化的反应方程式: 。
(4)加入石蕊试液的作用是: 。
16.(应届12分) NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点。NO亦被称为“明星分子”,试回答下列问题:
(1)NO对环境的危害在于 (填以下项目的编号)。
A. 破坏臭氧层
B. 高温下能使一些金属被氧化
C. 造成酸雨
D. 与人体血红蛋白结合
(2)在含Cu+离子酶活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝根离子在酸性水溶液中反应的离子方程式 。
(3)在常温下,将NO气体压缩到1.01×107Pa,在一个体积固定的容器里加热到50℃。发现气体的压强迅速下降,压强降至略小于原压强2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式。
___________________________________________________________________
(4)解释(3)中为什么最后的气体总压强小于原压强的2/3?
______________________________________________________________________。
15.(历届14分)为了研究铜与硝酸反应,化学兴趣小组设计了如下实验装置,其中a、b、c是活塞。

(1)装药品前,按图装置连接后,如何检验气密性?
______________________________________________________________________。
(2)按图装药品后,如果开启a和c,关闭b,则II中的现象是
______________________________________________________________________。
(3)如果将I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会观察,可以看到II里没入水中的导管有气泡冒出,导管内气体呈红棕色,液面上气体为无色,试用文字及方程式解释这一现象:____________________________________________。
(4)在实验(2)中,要使II里的气体始终保持无色,应该怎样操作?
______________________________________________________________________。
(5)在实验(2)中,如果装置I、II里液面上空间的总体积为VmL,空气中氧气的体积分数为21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余的铜为ng,II中所得溶液的体积也是VmL(不考虑装置外空气的可能进入)。则II中所得溶液的物质的量浓度是______________。
14.(7分)某校同学为探究Br 、I
、I 和Fe
和Fe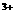 的氧化性强弱,进行了如下实验。
的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl , 振荡后静置,观察到下层液体呈紫红色;
, 振荡后静置,观察到下层液体呈紫红色;
②取少量FeSO 溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式__________________________;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号)_________;
A.Br >I
>I B.Fe
B.Fe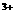 >Br
>Br C.Br
C.Br >Fe
>Fe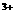 D.I
D.I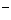 >Br
>Br
(3)已知Fe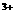 的氧化性强于I
的氧化性强于I ,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl
,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl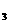 溶液 ②碘水 ③KI溶液 ④稀H
溶液 ②碘水 ③KI溶液 ④稀H SO
SO ⑤淀粉液
⑤淀粉液
(友情提示:请写出实验步骤、现象及结论)_________________________________
____________________________________________________________________________。
15(应届14分).铵盐受热分解,如图实验
 装置是验证氯化铵受热产生的气体是
装置是验证氯化铵受热产生的气体是
氨气和氯化氢,并将产生的气体重新
化合生成氯化铵。
(1)U形管B处所盛放的固体物质是 。
(2)证明氯化铵受热产生的气体是氨气和氯化氢的① ,当 说明有HCl生成,② ,
当 说明有NH3生成。
(3)若要在乙瓶中观察HCl和NH3重新化合生成NH4Cl的实验现象,请依据以上的实验装置写出有关的实验步骤和实验现象。
____________________________________________________________________________________________________________________________________________________________。
13. (7分)常温下,有一无色混合气体,可能由Cl2、HCl、NO、O2、CO2、N2、H2、NH3中的两种或多种组成,取此混合气体200mL进行实验如下:
(1)将此气体通过浓硫酸体积减少40mL;
(2)剩余气体通过足量过氧化钠固体,体积又减少40mL;
(3)剩余气体仍为无色,引燃后冷却至常温,体积又减少105mL;
(4)最后剩余气体为15mL,经分析知道其中氧气占1/3。则原混合气体中一定不含 ,一定含 ,其体积分别是 。
12.11.9g锡与100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可是 ( )
A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com