
题目列表(包括答案和解析)
2.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.C2H4和C4H8两物质中碳的质量分数相同,它们一定是同系物
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: ,NH4Cl的电子式为:
,NH4Cl的电子式为:
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
1.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘( )受控核聚变成氦(
)受控核聚变成氦( )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
A.氘( )受控核聚变成氦(
)受控核聚变成氦( )是一种化学变化
)是一种化学变化
B. 和
和 互为同位素
互为同位素
C.符号 中的“2”与符号
中的“2”与符号 中的“2”意义不同
中的“2”意义不同
D. 2和
2和 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
29.(12分)在省实验调演活动中,某校几个研究性学习小组的师生对金属镁在空气中燃烧的产物进行探究。
①第一小组同学根据所学知识认为镁在空气中燃烧的产物就是氧化镁。请你用化学方程式表示第一小组同学的观点: ;
②第二小组同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他们设计了如下装置进行实验:
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持第二小组同学的观点的实验现象除生成淡黄色固体外还有 ,理由是 ;
③第三小组同学对实验中生成的淡黄色固体产生了兴趣,他们向蒸发皿中的固体滴加少量水,现有刺激性气味的气体产生,淡黄色固体转变成白色。请写出上述过程中发生的化学反应方程式: ,生成淡黄色固体的化学方程式是 ;
④第四小组同学在探究上述实验的基础上又通过查阅资料得知,Al4C3能象淡黄色固体一样,遇水也能剧烈反应。请你写出Al4C3和水反应的化学方程式 。
28.(15分)
Ⅰ(7分)(1)25 ℃时,取0.2 mol·L-1盐酸与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合液中水电离出的c(H+)_________原盐酸中水电离出的c(H+);(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH)=__________ mol·L-1
(2)25 ℃时,如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
Ⅱ.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.70 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应: ;
②R2X2与ZX2反应: 。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
 (4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
(4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
27.. (14分)如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去)
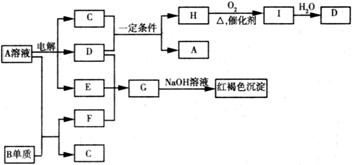
请回答下列问题:(1)写出A的化学式: ; G的化学式: ;
(2) B元素在元素周期表中的位置为: ;
(3)写出电解A溶液的离子方程式: ;
(4) 若向F的溶液中加入足量的NaOH溶液,可观察到的现象 ;
(5)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的负极材料可以是: ;
正极的电极反应是 。
26.(19分)
Ⅰ(6分)(1)下列操作正确的是 (填字母编号)(错选扣分)
A.将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH
B.制备Fe(OH)2时,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C.焰色反应操作是:
将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D.中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液或标准溶液
E.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
F.配制0.1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放人容量瓶中加水稀释
G.用盐析法除去淀粉溶液中混有的NaCl杂质
H.用待测液润洗滴定用的锥形瓶 I.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
J.用稀盐酸洗涤盛放过石灰水的试剂瓶 K.Na2CO3溶液保存在带玻璃塞的试剂瓶中
Ⅱ.(13分)已知在pH为4-5的溶液中, 几乎不水解,而
几乎不水解,而 几乎完全水解。某学生拟用电解
几乎完全水解。某学生拟用电解 溶液的方法测定铜的相对原子质量.其实验流程图如下:
溶液的方法测定铜的相对原子质量.其实验流程图如下:

试回答下列问题:
(1) 步骤①中加入A的化学式为______,其作用是____________;沉淀物B是_______(填化学式)。
(2)步骤②中所用部分仪器如下图所示:则A应连接直流电源的______极,写出B电极上发生反应的电极方程式______

(3)下列实验操作属必要的是________(填字母)。
A.称量电解前电极的质量 B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称重的操作中必须按如下顺序:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________。
(5)铜的相对原子质量的计算式是_________________。
(6)从能量转化的角度来看,步骤②的变化是将________能转化为________能。
13.下列叙述中,正确的是
①中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1醋酸所需同种碱液的量不同
②体积相同、pH相等的盐酸和硫酸溶液中,H+的物质的量相等
③常温下,pH=3的甲酸溶液中c(H+)与pH=11的氨水中的c(OH-)相等
④锌与pH= 4的盐酸反应比跟pH=3的醋酸溶液反应程度剧烈
A.①③ B.①④ C.② D.②③






|
|
|
老师寄语:态度决定一切,细节决定成败。
 高2007届理科 班 姓名__________
得分____________
高2007届理科 班 姓名__________
得分____________
12.下列四个实验结论中,肯定有错误的是
①有一瓶澄清的碱性溶液,做离子鉴定时得出结论是含有Ca2+、Fe2+、Na+、Cl-和
②一固体混合物溶于水后,检验出含 ,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。 ③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的
,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。 ③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的
④配制FeCl3溶液时,常将FeCl3固体溶于较浓的盐酸中,然后再用水稀释到所需的浓度
A.①② B.①③ C.②③ D.②④
11. 下列离子方程式中正确的是
 A.澄清石灰水中滴加少量Ca
(HCO3)2溶液:Ca2+ + OH + HCO3- H2O +
CaCO3↓
A.澄清石灰水中滴加少量Ca
(HCO3)2溶液:Ca2+ + OH + HCO3- H2O +
CaCO3↓
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至 沉淀完全:
沉淀完全:
2H++ +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O
C.Fe(OH)3溶解于氢碘酸(HI)溶液中:Fe(OH)3+3H+=Fe3++3H2O
 D.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
D.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
10.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);ΔH>0 则下列叙述正确的是
Z(g)+W(s);ΔH>0 则下列叙述正确的是
A.加入少量W,逆反应速率增大 B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡 D.平衡后加入X,上述反应的ΔH增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com