
题目列表(包括答案和解析)
4.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
3.设NA表示阿伏加德罗常数,下列叙述中,正确的是 ( )
A.常温常压下,16gO2和O3的混合物中共含有NA个氧原子
B.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78gNa2O2固体中所含阴、阳离子总数为4NA
D.在铜与硫的反应中,1mol铜原子参加反应失去的电子数为2NA
2.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.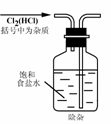 B.
B.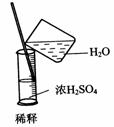
C.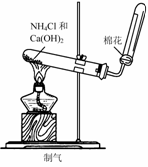 D.
D.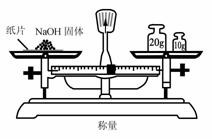
1.化学与科技、社会、生产密切结合,下列做法合理合法的是
A.汽油中添加乙醇制备“乙醇汽油”,可有效减少有害气体的排放。
B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观。
C.化妆品中添加含铬物质制美白润肤“SK-Ⅲ”,可使女性青春永驻。
D.汽水中添加林丹、毒死蜱和七氯等杀虫剂制“可口可乐、百事可乐”,增强口感和余味。
29、(9分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = _________ mol·L-1 c(H+) - c(MOH) = __________ mol·L-1
高三‘二诊’理科综合能力测试(化学部分)
28、(17分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
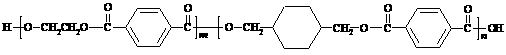
EG TPA CHDM TPA
已知:Ⅰ.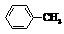



Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
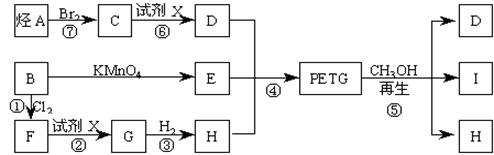
试回答下列问题:
(1)合成PETG的单体有_______种,反应②、⑥中加入的试剂X是_____________;
(2)⑤的反应类型是________________;
(3)写出结构简式:B______________________,I________________________;
(4)合成时应控制的单体的物质的量n(D):n(E):n(H)=__:_____:__(用m、n表示)。
(5)写出化学方程式:
反应③:____________________________________________________;
反应⑥:_____________________________________________________。
(6)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体共有______种.
27、(15分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的名称
A. C. E .
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为:
(3)已知DB2在一定条件下可转化为DB3,1mol DB2充分反应,放出98.3kJ的热量。该反应的热化学方程式是 ,工业上进行这一反应的设备是
,反应的适宜条件为 。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为
;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。若改用铁棒做阳极材料,则阳极的电极反应式为 。
26.(19分)I、(4分)在中学化学实验中学过的可用于分离或提纯的方法很多,如重结晶、过滤、盐析…,请将分离或提纯下列各混合物最适宜的方法的名称添入括号内
①除去生石灰中混有的石灰石 ( )
②除去碘中混有的碘化钠固体 ( )
③除去乙醇中溶解的少量食盐 ( )
④除去氢氧化铁胶体中混有的氯离子 ( )
II、(15分)某校研究性学习小组设计了如图所示装置进行有关实验,实验时将分液漏斗中A逐滴加入烧瓶B中,(图中铁架台、铁夹已略去,要求填写的试剂的均填化学式)
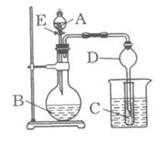 (1)若A为浓硫酸,B为第三周期金属元素的单质,
(1)若A为浓硫酸,B为第三周期金属元素的单质,
其在常温下难与水反应;C为品红溶液,实验
观察到C中溶液褪色,则B是 ,
简述判断B的理由 ,
若使C试管溶液恢复原来的颜色,可采取的操作
为 。
(2)若B为块状大理石,C为饱和Na2CO3溶液,实验中观察到小试管内溶液变浑浊,则C试管中发生反应的化学方程式为 。
(3)若B是生石灰,实验中观察到C溶液中先形成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭E,然后将C放入盛有沸水的烧杯中,静止片刻,观察到试管壁上出现光亮银镜。则A是 ,C是 与葡萄糖的混合液。该银镜反应的离子方程式为__ ,
仪器D在此实验中的作用是 。
(4)利用此套装置设计实验证明碳酸、醋酸、苯酚的酸性强弱,则A、B、C中放的试剂分别是 、 、 ,B、C的实验现象分别为B 、C 。若使现象明显,放入C中的溶液应是稀溶液还是浓溶液 。(填浓或稀)
13、下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高;晶体熔化时,化学键不一定发生断裂
|
C.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多
D. 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
第Ⅱ卷(非选择题)
12、 可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动
 D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol-1
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com