
题目列表(包括答案和解析)
3.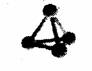 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
( )
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将吸收882kJ热量
2.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L,下列措施中能够减少SO2排放量的是 ①用天然气代替煤炭做民用燃料 ②使用水煤气或干馏煤气做燃料 ③硫酸厂使用V2O5作催化剂,加快SO2的转化速率 ④将块状煤粉碎,提高其燃烧效率 ⑤在煤中加入石灰后燃用 ⑥循环处理吸收塔放出的尾气 ( )
A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥
1.《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是 ( )
A.用膜分离的方法可以使海水淡化 B.高效催化剂可使水分解,同时释放能量
C.密度小于1g/cm3的溶液,浓度越大,密度越小 D.金属的电化腐蚀中,水参与了正极反应
24.(8分)某学生为了测定某种稀硫酸的物质的量浓度,用不同质量的纯锌粉与该稀硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
|
实验编号 |
加入锌粉的质量(g) |
稀硫酸溶液的体积(mL) |
生成硫酸锌的质量(g) |
|
1 |
2.0 |
50.0 |
5.0 |
|
2 |
4.0 |
50.0 |
|
|
3 |
6.0 |
50.0 |
14.9 |
|
4 |
8.0 |
50.0 |
19.3 |
|
5 |
10.0 |
50.0 |
|
|
6 |
12.0 |
50.0 |
19.3 |
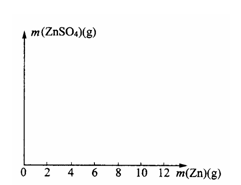 (1)其中第2、第5两个实验中生成硫酸锌的质量分别
(1)其中第2、第5两个实验中生成硫酸锌的质量分别
是 g、 g。
(2)在右图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉质量[m(Zn)]的关系示意图(需要标明关键点的横坐标和纵坐标的数据)。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为_______g,该稀硫酸的物质的量浓度为______mol/L。
23. (10分)有如下化学反应:2A(g)+B(g)
2C(g)(△H<0)
(10分)有如下化学反应:2A(g)+B(g)
2C(g)(△H<0)
(1)若将4mol气体A和2mol气体B在2L密闭容器中混合,经2s后测得C的浓度为0.6mol·L-1。则2秒时B的浓度为 mol·L-1。
 (2)若把amol气体A和b mol气体B充入上述密闭容器,达到平衡时,它们的物质的量满足n(A)+n(B)=n(C),则气体A的转化率为 。
(2)若把amol气体A和b mol气体B充入上述密闭容器,达到平衡时,它们的物质的量满足n(A)+n(B)=n(C),则气体A的转化率为 。
(3)如下图所示,将4mol气体A和2mol气体B混
合后置于体积可变的等压容器中,一定温度下达到平衡
状态X时,测得气体总物质的量为4.2mol。若A、B、C
起始的物质的量分别用a、b、c表示,试回答:
① 达到平衡状态X时的容器中,通入少量B气体,容器中
A的体积分数 (填“增大”、“减小”或“不变”)。若要使A的体积分数再升高到与平衡状态X相同,可采取的一种措施是 (只填一种即可)。
②若起始a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态X相同,则起始时C的取值范围为 。
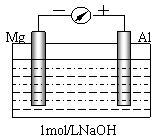
22.(10分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:____________________ _____;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
21.(14分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学 式 、 。
⑵右图是A与D形成的一种化合物的晶体结构示意 图,
其中的虚线表示 ,与每个“构成粒子”相邻的粒子
呈 空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为 。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
 ②试估算F单质晶体的燃烧热:_____ __。
②试估算F单质晶体的燃烧热:_____ __。
20.(12分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同。G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
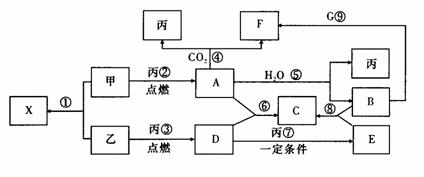
请回答:
(1)丙的名称为 ,C的化学式为 ,X的电子式为 。
(2)写出A与X 的溶液反应的化学反应方程式 。
(3)写出B与G溶液反应的离子方程式: 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号) __________。
19.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 (→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 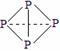 ,请画出N4H44+的结构式
。
,请画出N4H44+的结构式
。
⑷ 已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
18.(16分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。

根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是 。
(2)固体M中一定有的物质是 (写化学式)。
(3)写出A中发生反应的化学方程式(只写一个):
。
(4)写出B中析出黑色沉淀时发生反应的离子方程式 。
(5)根据题给条件,固体M中一种物质的质量可以确定,应为 g(用代数式表示)。
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是 (写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是 。
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为: 。
A.KSCN溶液 B.NaOH溶液 C.氨水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com