
题目列表(包括答案和解析)
25.(11分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式_______________________________;
(2)产物中硝酸铜的物质的量______________mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol;
(4)如混合物中Cu的物质的量为X,求X的取值范围________________。
0.01×6×10-3×50 mol x mol
x=0.0075mol
m (CaCO3) == 0.75g (1分) 相当于300毫克钙
所以,本品每片含主要成分碳酸钙0.75克(相当于钙元素300毫克)。
24.(1) 1.5×40/100×1000=600
(2)设:每片药片中含CaCO3的物质的量为x摩尔
2MnO4― ~ 5H2C2O4 ~ 5CaCO3
2 mol 5 mol
24.(9分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5 g(相当于钙元素600 mg),成人每天服用1片。”
(1)“1.5 g碳酸钙与600 mg的钙”的计量关系是如何得出来的,请列式表示;
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加 (NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1L溶液,取其20mL,然后用0.01 mol/L KMnO4 溶液滴定,反应中用去6 mL KMnO4溶液,发生的离子反应为:
2MnO4― + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2↑+ 8H2O
试通过计算回答该片剂中碳酸钙的含量,并仿照药品说明书的文本表达出来。
23.(1)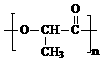
(2)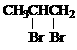 +2NaOH
+2NaOH
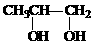 +2NaBr
+2NaBr
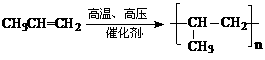
(3)
(4)
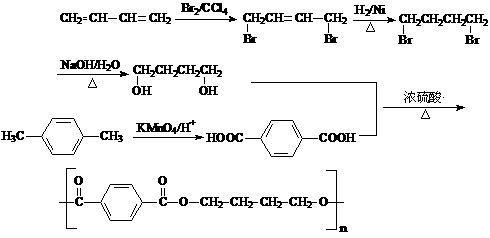
23.塑料是日常生活中常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
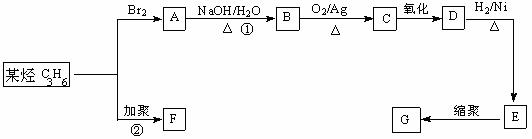
(1)写出高分子化合物G的结构简式:_____________________;
(2)写出反应①的化学方程式:_________________________________________;
(3)写出反应②化学方程式:_____________________________________________;
(4)PBT(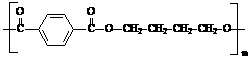 )是一种最重要的工程塑料之一。
)是一种最重要的工程塑料之一。
已知:①、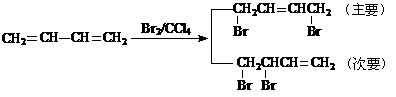
②、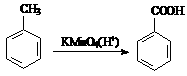
请设计方案以CH2=CHCH=CH2、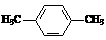 为原料合成PBT;请用反应流程图表示,并注明反应条件。
为原料合成PBT;请用反应流程图表示,并注明反应条件。
示例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
合成PBT的反应流程图为__________________________________________________
22.(1)E:CH2=CHCOOH;G:CH2=CHCOOCH3;R,基:-CH3。
(2)HCOOCH2CH=CH2;CH3COOCH=CH2。
 (3)X:加成反应;Y:消去反应;Z:加聚反应。
(3)X:加成反应;Y:消去反应;Z:加聚反应。
(4)①HC≡CH + CO + H2 H2C=CHCOOH
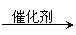 ②C H3CH2COOH
+ CH3OH
CH3CH2COOCH3 +H2O
②C H3CH2COOH
+ CH3OH
CH3CH2COOCH3 +H2O
22.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:

图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母) 。
(3)反应类型:X 、Y 、Z 。

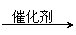 (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A+CO+H2O E;②F+D H。
① ;
② 。
21. (1) 热能; 小于; 放热
(2) 434 kJ·mol-1
(3) FeO(s)+CO(g)==Fe(s)+CO2(g); ΔH= -11 kJ·mol-1
21.热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 的形式体现的。
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为 0(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g); ΔH= 436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g);ΔH= - 436 kJ·mol-1]。
已知: H2(g)+Cl2(g)=2HCl(g); ΔH= -185 kJ·mol-1
ΔH298(H2)= 436 kJ·mol-1 ,ΔH298(Cl2)= 247 kJ·mol-1
则 ΔH298(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g); ΔH= -25 kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g); ΔH= - 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g); ΔH= 19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com