
题目列表(包括答案和解析)
1.(1)B (2)①(I)蒸馏水或饱和碳酸氢钠溶液 (Ⅱ)吸收NH3 (Ⅲ)过滤 ② (I)NH3 , CO2 (Ⅱ) 增大气体与溶液接触面积,提高CO2 吸收率 (3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可)
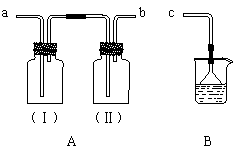
9.(W.17)(ⅰ)用装置A、B和乳胶管组成装置,用于收集已经干燥的NH3气体(①装置A已经过了气密性检查;②可供选用的试剂有碱石灰、水和酚酞)。
回答下列问题:
⑴干燥剂碱石灰应放在________中(填广口瓶代号)。
⑵NH3气体进入B中出现的现象是___________________________________。
⑶若将上述可供选用的试剂改成浓硫酸和石蕊溶液,仍用装置A、B和乳胶管组成装置,
还可收集其它气体,请列举可收集的气体两种___________________。
(ⅱ) 粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
⑴蒸发操作中使用到的瓷质仪器的名称为____________________。
⑵该同学将所得精盐配成溶液,用于另一实验。实验中需要用80mL,1mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_________g,用于定容的仪器的规格和名称_______________________________。
专题 化学综合实验设计(答案)
8、(T.23)“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只控第一个反应,就好像多米诺骨牌游戏一样,下图就是一个“化学多米诺实验”在实验过程中的装置图。各装置中试剂或物质是:(A) 2mol/LH2SO4 (B) Zn (C) 2mol/H2SO4+CuSO4 (D) Zn E) CuSO4溶液 (F) NH3·H2O (G)30%H2O2 (H) 饱和H2S溶液 (I) NaOH溶液。
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
该反应产物可作为H2O2分解的催化剂。
请回答下列问题:
(1)进行实验前必须进行的操作是 。 (2)反应过程中B与D两容器中反应速率比较B D(填<、>、=),原因是 。
(3)H中的现象是 。
(4)I中可能发生的反应的化学方程式 。
 (5)A和B之间导管a的作用是
。
(5)A和B之间导管a的作用是
。
(6)在该实验中不涉及的反应类型是(填序号) 。①分解反应 ②化合反应 ③置换反应 ④复分解反应。
7. (L.18)下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)盛放药品前,检验此装置的气密性的操作方法和现象是:_______________ 。
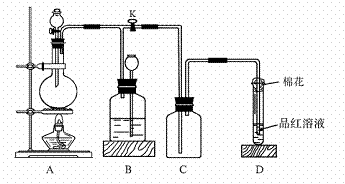 (2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:_____________
。
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:_____________
。
(3)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________,其作用是:_______________________ _。(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2.

试评价上述各方案是否严密,并说明理由: 。
6.(J.28)某课外活动小组拟用下面装置模拟一个生产过程,请据图回答以下问题:

(1)打开F的活塞,瓶D中可产生一种气体,该气体是(写化学式) ;该反应的化学方程式为 。
(2)瓶B的作用是 。 (3)最终在烧杯C中结晶出一种晶体,该晶体滤出后,对其充分加热,该晶体分解,可得到一种白色粉末。烧杯C中反应的化学方程式为 。
(4)该反应所得的产品产量和打开分液漏斗E、F的先后顺序有关,为了得到较高的产量应先打开分液漏斗 (选填“E”或“F”)
(5)若不考虑尾气的吸收问题,该装置C中有一处不太合理的地方,你认为应如何改进? 。
5.(H.23)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。

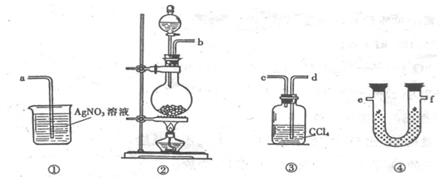
(1)请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a。
(2)U形管中所盛试剂的化学式为 。 (3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
4.(H.22)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3.Cu(NO3)2.AgNO3。(加热及夹持装置未画出)
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程式: 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
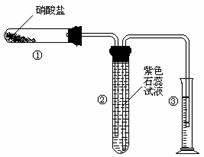 (3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
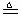 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
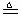 (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
3.(E.27)微型化学实验(简称ML)是绿色化学新理念在中学化学实验中的应用。微型实验具装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。下图是某同学设计的NH3的催化氧化(附着在玻璃纤维上的Cr2O3作催化剂),并检验反应生成的酸性物质的微型装置(图中必要的铁架、铁夹、微型酒精灯等均已略去)。实验可提供的药品有:① NH4Cl、Ca(OH)2的混合物;② 浓氨水;③ KClO3和MnO2;④ 蒸馏水;⑤0.5 mol/LNaOH溶液;⑥ 酚酞试液;⑦ 浓H2SO4;⑧ 6 mol/LNaOH溶液 。试回答下列问题:
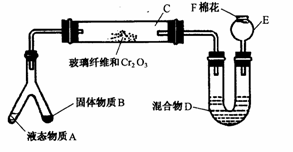 (1)微型叉形管中液态物质A是
,B是 。
(1)微型叉形管中液态物质A是
,B是 。
(2)C处发生的化学反应方程式是 。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是 ,
。实验过程中是D变化现象为 。
(4)F处的棉花应蘸取的物质是 。
2.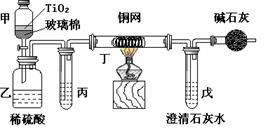 (C.19)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(C.19)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴ 甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵ 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,
装有碱石灰的干燥管的作用是 。
⑶ 戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因(不一定填满)。
① 。
② 。
③ 。
请提出一个能提高准确度的建议(要有可操作性,且操作简单)
。
25.(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
(2)0.025
(3)0.005 0.005
(4)0.005<x<0.015
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com