
题目列表(包括答案和解析)
5.以上测定结果说明水样具有什么性质?
答案:1.步骤1:2Mn2++O2+4OH-=2MnO(OH)2(1分)
步骤2:2I-+MnO(OH)2+4H+=Mn2++I2+3H2O(1分)
或3I-+MnO(OH)2+4H+=Mn2++I3-+3H2O
步骤3:I2+2S2O32-=2I-+S4O62-(1分)
或I3-+2S2O32-=3I-+S4O62-
4.计算陈放水样中氧的含量(单位mg·L-1)。
3.计算新鲜水样中氧的含量(单位mg·L-1)。
2.计算标准溶液的浓度(单位mol·L-1)。
1.写出上面3步所涉及的化学反应方程式。
3.在20.0℃下密闭放置5天的水样102.2mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
6.水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0℃下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80mL。已知该温度下水的饱和O2含量为9.08 mg·L-1。
5.二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
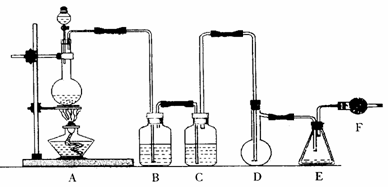 试回答下列问题:
试回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)装置B应盛放的药品是 ,C中是 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59℃.最好采用 方式加热。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
|
 答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)饱和食盐水(或水) 浓硫酸
(3)增大反应接触面
(4)水浴 将锥形瓶放人冰水中冷却
(5)碱石灰(或固态氢氧化钠和生石灰);防止空气中水蒸气进入E中并吸收残留的氯气。
4.下列实验中所选用的仪器或结论不合理的是 BD
(填字母,多选扣分)
A.用托盘天平称量重11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.用酸式滴定管量取浓硫酸配制一定浓度的稀硫酸时,某同学取前平视,取后俯视,所配硫酸的浓度偏高。
F. 把水滴加到脱脂棉包住的过氧化钠粉末上,脱脂棉可以燃烧,说明该反应为放热反应。
3.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将PH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)下列实验没有错误的是
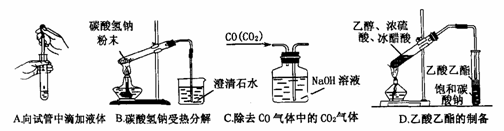
(3)下图为常见仪器的部分结构(有的仪器被放大)
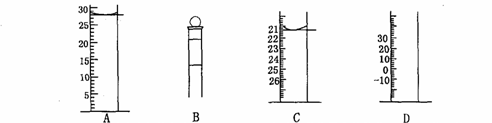
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
答案:(1)A E (2)D (3)28.0 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com