
题目列表(包括答案和解析)
18.瑞士昆虫学家保罗•米勒因合成DDT于1948年获得诺贝尔生理医学奖。联合国世界卫生组织曾评价说:“单独从疟疾看,DDT可能拯救了5000万生命”。但进一步的观察与研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒,我国于1983年停止生产和使用DDT。DDT可以用电石为原料经以下途径制得。
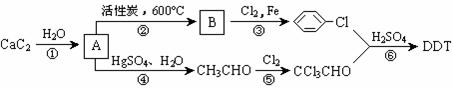
(1)写出A、B的结构简式:A ,B 。
(2)写出第⑤步反应的化学方程式: _________________。
(3)杀虫剂“1605”属于硫代磷酸酯,本身对人畜毒性远强于DDT,但DDT已经被禁用,而“1605”尚未禁用,这是因为 _________。
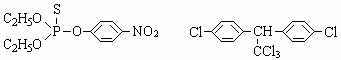
(a)杀虫剂“1605” (b)杀虫剂DDT
由结构简式分析可知:“1605”在使用过程中,不能与 物质混合使用,否则会因
而失效。
(4)DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(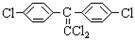 )。在实验室中DDT在NaOH醇溶液的作用下也可实现这种转化。表示这种转化的化学方程式为 _________________________。
)。在实验室中DDT在NaOH醇溶液的作用下也可实现这种转化。表示这种转化的化学方程式为 _________________________。
17.(14分)工业苯酚纯度的测定过程如下:准确称取0.2g工业用苯酚于盛有5mL10%NaOH溶液的100mL烧杯中,再加少量水溶解,然后定量转入250mL容量瓶中,再用水稀释到刻度,混匀后,准确吸取此溶液20mL于碘量瓶(带玻璃塞)中,再加入物质的量之比为1:5.5的KBrO3-KBr标准溶液10mL于碘量瓶中(其中KBrO3的浓度为0.02mol/L),并加足量的盐酸酸化,用塞子塞紧碘量瓶振荡1-2min,静置5min,此时生成三溴苯酚白色沉淀和Br2,再迅速加入10%KI溶液10mL,摇匀后静置5min,并用少量水冲洗瓶塞及瓶颈上附着物,加2mL0.5%淀粉溶液,用0.05mol/LNa2S2O3标准溶液滴定到终点,记下消耗的Na2S2O3标准溶液的体积为V。已知碘和硫代硫酸钠的反应为I2+2S2O32-=2I-+S4O62-,请回答下列问题:
(1)0.2g苯酚为何先溶于NaOH溶液?
____________________________________________________________________________。
(2)写出所有的化学方程式_______________________________________________________
____________________________________________________________________________。
(3)为何用碘量瓶不用锥形瓶?__________________________________________________。
(4)为何在配制250mLKBrO3-KBr溶液时采用物质的量之比为1:5.5不是1:5?
_________________________________________________________________________。
(5)为什么不直接用浓溴水直接滴定苯酚溶液测工业用苯酚的含量?
__________________________________________________________________________。
(6)工业苯酚的纯度为__________________________________
5、_____________、6、_______________。
3、_____________、4、_______________
1._____________、2________________
16.画出6种用于在化学实验中防倒吸装置(12分)
15.(10分)(1)写出第四周期18种元素的元素符号和名称:
元素符号:_________________________________
名称 :_________________________________
(2)原子序数为24、29的原子的电子排布式_________、_________
(3)114号元素所元素周期表中的位置是第____周期、第____族
14.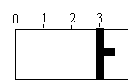
 (12分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2SO3
(g) 。
(12分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2SO3
(g) 。
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,容器内,V(SO3)=_____________L;该反应中SO2 的转化率为________。
(2)若开始时,充入容器的起始物质分别是①2 L SO2 和1 L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是 (用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量,写出SO2 发生氧化反应的热化学方程
_____________________________________________________________。
13.(8分)在0.1mol/LNa3PO4溶液中,存在着多种离子,请你写出四个关于这些离子浓度关系的恒等式:
______________________________
______________________________
_____________________________
______________________________。
12.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:
MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方
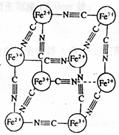 体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的
体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的
阴离子晶胞结构如图示,下列说法不正确的是
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为
50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为M1Fe2(CN)6,且M为+1价
第Ⅱ卷(非选择题 共102分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com