
题目列表(包括答案和解析)
19.为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子存在
C.一定有C1-离子存在 D.不能确定HCO3-离子是否存在
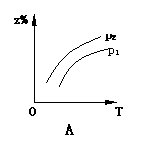
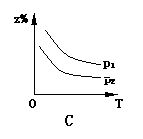
18.已知反应X(g)+3Y(g) 2Z(g);△H<0,z在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量z%随温度和压强变化的曲线应为 ( )
2Z(g);△H<0,z在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的百分含量z%随温度和压强变化的曲线应为 ( )


16.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量CO2:Ca2+ +2ClO-+CO2+H2O=CaCO3↓+2HClO
B.石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C. Ca(HCO3)2与过量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
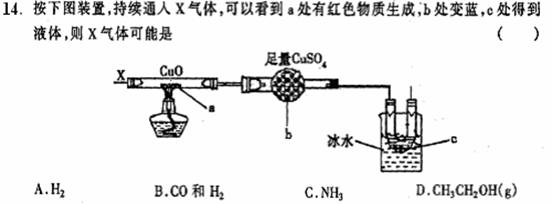
D.氯气与水反应C12+H2O=2H++Cl-+ClO-
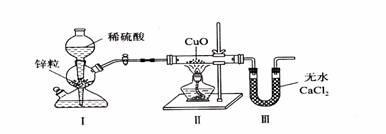 17.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差。某同学通过实验得出的结论是m(H):m(O)>1:8。下列对导致这一结果原因的分析中,一定不合理的是( )
17.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差。某同学通过实验得出的结论是m(H):m(O)>1:8。下列对导致这一结果原因的分析中,一定不合理的是( )
A.CuO没有全部被还原 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中的CuO粉末可能不干燥 D.Ⅰ、Ⅱ装置之间缺少干燥装置
15.已知胆矾溶于水时温度降低,室温下将1mol无水硫酸铜配成溶液时放出的热量为Q1kJ,又知胆矾分解的热化学方程式为∶
CuSO4•5H2O(s)=CuSO4(s) + 5H2O(l) ΔH= +Q2kJ/mol 则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
13.对可逆反应4A(g)+5B(g)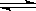 4C(g)+6D(g) △H>0,下列叙述中,正确的是 ( )
4C(g)+6D(g) △H>0,下列叙述中,正确的是 ( )
A.化学反应速率关系是:2v正(A)=3v正(D)
B.若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态
C.达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大
D.达到化学平衡后,升高温度,则C的质量分数增大
12.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A. 元素非金属性由弱到强的顺序为X<Y<Z
B. 原子半径由大到小的顺序为Z>Y>X
C. 3种元素的气态氢化物中Z的气态氢化物最稳定
D. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
11.在某无色透明溶液中加入铝粉能放出H2,下列各组离子在该溶液中有可能共存的是( )
A.Cu2+、OH-、SO42- B.Ca2+、H+、NO3-
C.NH4+、Cl-、SO42- D.K+、Ba2+、HCO3-
10.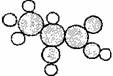 下图是一种有机物的比例模型.该模型代表的有机物可能是
下图是一种有机物的比例模型.该模型代表的有机物可能是
A.饱和一元醇 B.羟基羧酸
C.羧酸酯 D.饱和一元醛
9.常温下,某一元强酸HA和一元弱碱BOH的pH之和为14,有关这两种溶液混合的说法中不正确的是
A.混合之前两种溶液中由水电离产生的c(H+)相同
B.若混合后恰好完全中和,反应液中水的电离程度比纯水中大
C.若混合后溶液呈中性(pH=7),V(HA)>V(BOH)
D.若等体积混合两种溶液,反应后因生成强酸弱碱盐而使溶液呈酸性
8.提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
|
|
不纯物质 |
除杂试剂 |
分离方法 |
|
A |
苯(甲苯) |
KMnO4(酸化),NaOH溶液 |
分液 |
|
B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
|
C |
乙酸乙酯(乙酸) |
KOH溶液 |
分液 |
|
D |
苯(苯酚) |
浓Br2水 |
过滤 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com