
题目列表(包括答案和解析)
5. A、B、C为短周期的三种元素,已知A、B处于同一周期,A、C的最低价离子分别为A2-和C-,A2-的离子半径大于C-,B2+与C-具有相同的电子层结构。以下叙述中不正确的是
A.原子半径A>B>C B.原子序数A>B>C
C.离子半径A2->C->B2+ D.最外层电子数C>A>B
4. 设NA为阿伏加德罗常数,下列说法不正确的是
A.18 g H2O中含有质子数为10 NA
B.标准状况下22.4 L辛烷完全燃烧,生成CO2分子数为8NA
C.28 g N2与CO的混合气体所含的原子数为2NA
D.在 1 L 2 mol/L的Mg(NO3)2溶液中含有的NO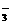 为4NA
为4NA
3. 下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:
Ca2++HCO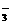 +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O
B.苯酚钠溶液中通入过量CO2:
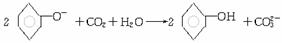
C.氯化铁溶液中通入少量H2S气体
2Fe3++S2-====2Fe2++S↓
D.氯化亚铁溶液中加入硝酸
3Fe2++4H++NO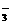 ====3Fe3++2H2O+NO↑
====3Fe3++2H2O+NO↑
2. 将标准状况下的某气体(摩尔质量为Mg·mol-1)溶于ag水中,所得到溶液的密度为bg·cm-3,物质的量浓度为c mol·L-1,则溶入水中的该气体的体积是
A.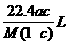 B.
B. 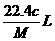 C.
C. 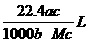 D.
D. 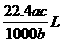
1. 下列实验中①配制一定物质的量浓度的溶液 ②用pH试纸测定溶液的pH ③过滤 ④蒸发 ⑤硫酸铜晶体里结晶水含量的测定,操作过程中均必须要用到的仪器是
A.烧杯 B.胶头滴管 C.玻璃棒 D.漏斗
5.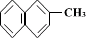 、
、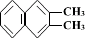 、
、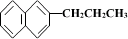
都属于萘的同系物。萘和萘的同系物分子组成通式是( )
A.CnH2n-8(n>10) B.CnH2n-10(n≥10)
C.CnH2n-12(n≥10) D.CnH2n-6(n≥11)
6.在一定条件下,CO和CH4燃烧的热化学方程式分别为( )
 2CO(g)+O2(g) 2CO2(g);
△H=-566kJ·mol-1
2CO(g)+O2(g) 2CO2(g);
△H=-566kJ·mol-1
 CH4(g)+2O2(g) CO2(g)+2H2O(l); △H=-890kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(l); △H=-890kJ·mol-1
由等物质的量的CO和CH4的混合气体共3mol,在上述条件下完全燃烧时释放的热量为( )
A.1092kJ B.1759.5kJ C.2184kJ D.879.75kJ
7.若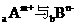 的核外电子排布相同,则下列关系不正确的是(
)
的核外电子排布相同,则下列关系不正确的是(
)
A.离子半径Am+<Bn- B.原子半径A<B
C.A的原子序数比B大(m+n) D.b=a-n-m
8.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的是( )
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)> c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
C.c(OH-) =c(H+)+c(H2CO3)+c(HCO3-)
D.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
9.下列离子方程式书写正确的是( )
A.金属钠投入水中 Na+H2O=Na++OH-+H2↑
B.氢氧化亚铁溶于稀硝酸溶液 Fe(OH)2+2H+=Fe2++2H2O
C.氯化铁溶液中加过量氨水 3NH3·H2O+Fe3+=3NH4++Fe(OH)3↓
D.碳酸钙溶于醋酸溶液中 CaCO3+2H+=Ca2++H2O+CO2↑
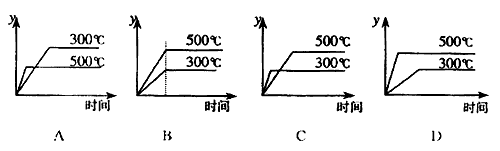
10.对于热化学方程式: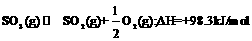 的描述有如下四个图象,其中正确的是(y表示SO2的含量)( )
的描述有如下四个图象,其中正确的是(y表示SO2的含量)( )
11.主链为4个碳原子的某烷烃有2种同分异构体,则相同碳原子数、主链也为4个碳原子的烯烃,其同分异构体有( )
A.3种 B.4种 C.5种 D.2种
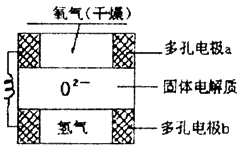
12.固体氧化物燃料电池是以固体氧化锆--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①有O2参加反应的a极为电池的负极
②b极对应的电极反应为:H2-2e-+O2-=H2O
③a极对应的电极反应为:O2+2H2O+4e-=4OH-
④该电池的总反应方程式为: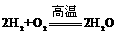
A.③④ B.②③ C.②④ D.①②
13.某无色溶液能与镁粉作用产生氢气,此溶液中可能大量存在的离子组是( )
A.K+、Ba2+、AlO2-、CO32-
B.Al3+、Fe3+、HCO3-、SO32-
C.Ca2+、H+、Cl-、NO3-
D.H+、Na+、Cl-、SO42-
14.设NA为阿伏加德罗常数,则下列说法正确的是( )
A.22.4L乙烯中含有的分子数为NA
B.0.1L0.1mol/L的CH3COOH溶液中含有的分子数为0.01NA
C.含0.1molH2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.1NA
D.1molSiO2晶体中含有2NA Si-O键
15.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是( )
A.NCl3跟水反应的产物为NH3和HClO
B.NCl3跟水反应生成NH4Cl、O2和Cl2
C.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
D.NCl3的电子式应表示为: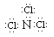
16.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:①Cu与稀硝酸反应制取,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;②Cu与浓硝酸反应制取,Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;③首先氧气与铜屑生成氧化铜,氧化铜与稀硝酸反应制取,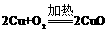 ;CuO+2HNO3=Cu(NO3)2+H2O;下列说法不正确的是( )
;CuO+2HNO3=Cu(NO3)2+H2O;下列说法不正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
非选择题
17.下图中a为生铁,A、B两个烧杯中为海水,C烧杯中为1mol·L-1的稀硫酸。
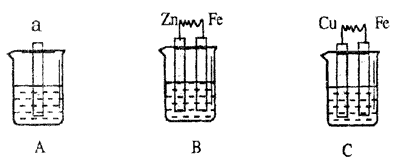
(1)C中Cu极的电极反应式为______________________________。
(2)A中Fe的腐蚀过程中发生反应的化学方程式为:
___________________________________________________________;
___________________________________________________________。(3)B中Zn极的电极反应式为______________,Zn极附近溶液的pH(填“增大”、“减小”或“不变”)_________________。
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是____________。
18.同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列写出相对应的元素符号:
A________________B______________C______________
D________________E______________F_______________
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式:
___________________________________________________________;
___________________________________________________________。
(3)若1mol F的最高价氧化物水化物与C的最高价氧化物水化物恰好完全反应,则等物质的量的C的最高价氧化物水化物与A的最高价氧化物水化物反应消耗_____________mol A的最高价氧化物水化物。
19.根据下面的反应路线及所给信息填空。
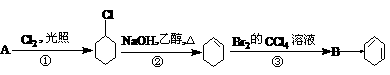
(一氯环已烷)
(1)A的结构简式是________________,B的名称是____________。
(2)①的反应类型是________________,④的反应类型是_________。
(3)反应③的化学方程式是_________________________________。
20.如图,将一小块钠放在石棉网上加热。回答下列问题:
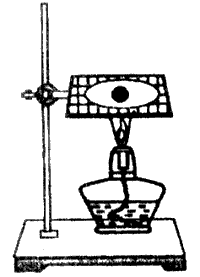
(1)观察到的实验现象有:__________________________________和黑色固体物质生成。
(2)产生以上现象的主要化学反应方程式为:
______________________________________________________。
21.在常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全除掉了氧化物)的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
(1)写出以上反应的离子方程式_____________________________;
(2)你认为出现以上现象的可能原因是:
假设①____________________________________________________;
假设②____________________________________________________。
(3)请设计实验对以上的假设进行验证:
①_________________________________________________________
___________________________________________________________
②_________________________________________________________
___________________________________________________________
(4)要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:
①_______________________________________________________;
②_______________________________________________________;
③_______________________________________________________;
④_______________________________________________________.
22.在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下表格:
试填空:
 时间(s) 时间(s)浓度 |
0 |
20 |
40 |
60 |
80 |
100 |
|
C(N2O4)moL·L-1 |
0.100 |
c1 |
0.50 |
C3 |
a |
b |
|
C(NO2)moL·L-1 |
0.000 |
0.060 |
C2 |
0.120 |
0.120 |
0.120 |
(1)该反应的化学方程式为_____________________________达到平衡时四氧化二氮的转化率为________________%,表中c2_________c3、a______b(填>,<,=)
(2)20s时四氧化二氮浓度c1_____________moL·L-1,
0s -- 20s四氧化二氮的平均反应速率为______________moL·L-1·s-1
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_________________moL·L-1.
23.现有由等质量的NaHCO3和KHCO3组成的混合物ag,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为____________。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为______nol。
(3)如果盐酸过量,生成CO2的体积为________________L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道_______________________。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是___________________。
4.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:①加热时放出的气体可使品红溶液褪色②加碱调pH至碱性后,加热时放出的气体可使用润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀HNO3。对于上述微粒不能确认其在原溶液中是否存在的是( )
A.SO42+ B.H2SO3 C.NH4+ D.Br-
3.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是( )
A.生成的氢气中只含有D2
B.生成的氢气中含有H2、HD、D2
C.以上判断都不正确
D.生成的氢气中只含有H2
2.下列物质中,不能与盐酸反应,但能与氢氧化钠溶液反应的是( )
A.NaHCO3 B.(NH4)2S
C.SiO2 D.Al(OH)3
1.“绿色化学”越来越受到人们的重视,下列可以看作绿色氧化剂的是( )
A.浓盐酸 B.双氧水 C.硝酸 D.氯水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com