
题目列表(包括答案和解析)
14.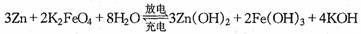 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:
下列叙述不正确的是
A、放电时负极反应式为:Zn-2eˉ+2OHˉ=Zn(OH)2
B、放电时每转移3mol电子,正极有1 mol K2FeO4被氧化
C、充电时阳极反应式为:Fe(OH)3 - 3e-+5OHˉ=FeO42ˉ+4H2O
D、放电时正极附近溶液的碱性增强
13.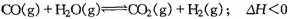 在容积可变的密闭容器中存在如下反应:
在容积可变的密闭容器中存在如下反应:
12.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置
已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋
 剂乙基雌烯醇(etylestrenol)的结构如右图所示。下列叙述中正确
剂乙基雌烯醇(etylestrenol)的结构如右图所示。下列叙述中正确
的是
A、该物质可以视为酚类
B、在浓硫酸作用下,分子内消去一个水分子,产物有二种同分异
构体
C、能使溴的四氯化碳溶液褪色
D、该物质分子中的所有碳原子均共面
11.工业生产中物质的循环利用有多种模式。例如:
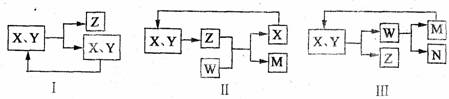
下列表述正确的是
A、图I可用于合成氨中的N2、H2的循环
B、图I可用于氨碱法制纯碱中CO2的循环
C、图Ⅱ可用于电解饱和食盐水中NaCl的循环
D、图Ⅲ可用于氨氧化法制硝酸中NO的循环
9,下列叙述中,结论(事实)和对应的解释(事实)均不正确蚺是
A、金刚石的熔沸点高于晶体硅,因为C一C键能大于Si一Si键能
B、稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
C、二氧化硅晶体中不存在简单的SiO2分子,因为其晶体是含有硅氧四面体的空间网状结构
D、分子空间构型为正四面体结构的分子中化学键的键角不一定是109028’,因为键角还有可能为60°
10.一定能在下列溶液中大量共存的离子组是
A、使紫色石蕊试液变蓝的溶液:Na+ AlO2- S2ˉ SO42ˉ
B、pH=0的溶液:Zn2+ NO3- Cl- I-
C、由水电离的c(H+)=10ˉ14 mol/ L-l的溶液中:Ba2+ K+ Na+ HCO3-
D、含有大量Al3+的溶液:H+ Cu2+ Mg2+ SO42-
8.下列有关热化学方程式的叙述中,正确的是
A、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l);△H=十57.4 kl/mol
B、已知C(石墨,s)=C(金刚石,s);△H> 0,则金刚石比石墨稳定
C、已知2H2(g)十O2(g)=2H2O(g);△H=-483 6 kJ/mol,则H2的燃烧热为 241.8kl/mol
 D、已知
D、已知
则△H1<△H2
7.下列物质不能通过化合反应得到的是
A、HNO3 B、Cu2(OH)2CO3 C、Ca(HCO3)2 D、H2SiO3
6.用NA表示阿伏加德罗常数,下列说法中一定正确的是
A、1 mol甲烷中的氢原子被氯原子完全取代,需要2NA C12
B、常温常压下,mg乙烯与mg丙烯中均含有(3m/14)NA对共用电子对
C、标准状况下,22.4 L Br2中所含的分子数为NA
D、1 mol·L -1 Mg(NO3)2溶液中含有NO3-的数目为2NA
5.下列离子方程式或电极反应式正确的是
A、用氢氧化铝胶囊治疗胃酸过多:OHˉ+H+=H2O
B、日常生活使用漂白粉漂白:CO2+H2O十Ca2++2ClOˉ=CaCO3↓十2HClO
C、电解法精炼粗铜(含金、银、锌等杂质)的阴极反应式:Cu-2eˉ=Cu2+
D、用Na2S溶液吸收超量的SO2: S2-+2SO2+2H2O=2HSO3-+H2S↑
4.下列各图所示的实验原理、方法、装置和操作正确的是

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com