
题目列表(包括答案和解析)
12.已知氨水的密度比纯水的小。向50g质量分数为ω1,物质的量浓度为c1的浓氨水中加入Vml蒸馏水,稀释后得质量分数为ω2,物质的量浓度为c2的稀氨水。若c1=c2,则下列判定正确的是 ( )
A .ω1=2ω2 V<50 B. ω1<2ω2 V<50
C. ω1>2ω2 V>50 D.ω2<ω1<2ω2 V>50
11.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是 ( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D.N3-与CO2含相等电子数
10.下列离子方程式不正确的是 ( )
A.向Mg(HCO3)2过量溶液加入过量石灰水:
Mg2+ + 2HCO3- + 2Ca2+ + 4OH-== 2Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.向AgNO3溶液中加入过量氨水:Ag+ + 3NH3·H2O == [Ag(NH3)2]+ +NH4+ +OH-+ 2H2O
C.向NaClO溶液中滴加少量FeCl3溶液:Fe3+ + 3ClO-+ 3H2O== Fe(OH)3↓+ 3HClO
D.向Fe(SCN)2溶液中滴加少量稀硫酸酸化的H2O2溶液:
2Fe2+ + 6SCN-+ H2O2 + 2H+== 2Fe(SCN)3 + 2H2O
9.已知反应:KI + 5 KIO3 +3H2X == 3I2 + 3K2SO4+ 3H2O,有关H2X的判定正确的是 ( )
A.H2S B.H2SO3 C.H2S2O8 D.H2SO4
8.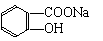
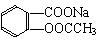 将
转变为 可采用的方法是 ( )
将
转变为 可采用的方法是 ( )
①与NaOH溶液共热后,通入足量的CO2 ②溶解、加热后,通入足量的SO2
③与稀H2SO4共热后,加足量的NaOH溶液 ④与稀H2SO4共热后,加足量的NaHCO3溶液
A.①和② B.②和③ C.①和④ D.②和④
7.(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4==N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将反应后的混合气体通入BaCl2溶液中,将 ( )
A.无沉淀生成 C.生成BaSO4沉淀
B.生成BaSO3沉淀 D.生成BaSO4和BaSO3沉淀
6.下列事实与氢键有关的是 ( )
A.水结成冰后体积膨胀
B.水加热到很高的温度都难以分解
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
1.2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.22.23.24.25.26.27.28.29.30.31.
A.B.C.D. ⑴⑵⑶⑷⑸⑹⑺⑻ ①②③④⑤⑥⑦⑧①②③④⑤⑥⑦⑧
12.(15分)化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。
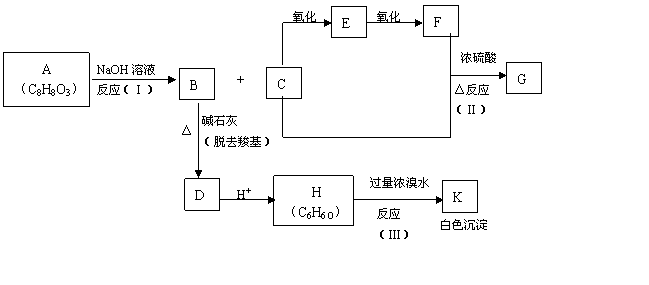
回答:
(1)下列化合物可能的结构简式:
A ,
E ,
K 。
(2)反应类型
(Ⅰ) ,
(Ⅱ) ,
(Ⅲ) ,
(3)反应方程式:
H→K: ,
C→E: ,
C+F→G: 。
11.(15分)实验室中有一瓶氯化钾和氯化钙的固体混合物,通过下面实验可确定核混和物中氯化钾和氯化钙的质量比,也可制得纯净的氯化钾。根据实验步骤填写下列空白。

 (1)调整零点时,若指针偏向左边,应将左边的螺丝帽向
(填左、右)旋动。某学生用已知质量Y克的表面皿,准确称取W克样品。他在托盘天平的右盘上放入(W+Y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如图所示)。下面他的操作应该是
,使
。
(1)调整零点时,若指针偏向左边,应将左边的螺丝帽向
(填左、右)旋动。某学生用已知质量Y克的表面皿,准确称取W克样品。他在托盘天平的右盘上放入(W+Y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如图所示)。下面他的操作应该是
,使
。
(2)加入的A是 ,检验A是否过量的方法是 。
过滤时,某学生的操作如下图。请用文字说明图中的错误是 ,
。
(3)滤液中加入的B物质是 ,应该加入过量的B物质,理由是 。为了检验沉淀是否洗净,应在最后几滴洗出液中加入 ,若 ,表示沉淀已洗净。
 (4)得到固体C是
,该混和物中氯化钾与氯化钙质量的计算式是
。
(4)得到固体C是
,该混和物中氯化钾与氯化钙质量的计算式是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com