
题目列表(包括答案和解析)
28. (9分)
A、B、C是中学化学中常见的三种元素的单质。A、B、C及其他物质之间的关系如下图所示,其中B、D、E、F溶液显酸性,又知常温下B为气态。
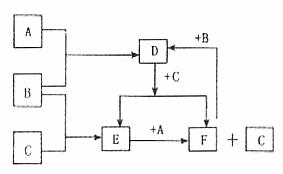
请回答下列问题:
(1)A、B、C三种单质的化学式(分子式)分别是A___________,B___________,C___________,其中A、C单质的晶体类型属于______________________。
(2)B与C反应生成E时观察到的现象是_________________________________。
(3)D和C反应生成E和F的离子方程式:______________________。
(4)在测定C的硫酸盐晶体结晶水含量实验中。若坩埚质量为m,坩埚与C的硫酸盐晶体总质量为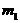 ,加热后称量坩埚与C的无水硫酸盐总质量为
,加热后称量坩埚与C的无水硫酸盐总质量为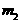 ,则晶体中结晶水的质量分数ω=__________________(写计算式)。如果实验中加热温度过高致使固体出现黑色,则测定结果___________(填“偏高”,“偏低”,“不变”)。
,则晶体中结晶水的质量分数ω=__________________(写计算式)。如果实验中加热温度过高致使固体出现黑色,则测定结果___________(填“偏高”,“偏低”,“不变”)。
用下图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均
已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
⑤ |
1.2g |
无其他物质 |
|
|
⑥ |
1.2g |
CuO 0.5g |
|
|
⑦ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(4)上述实验中的“待测数据”指___________________________________________;
(5)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是______________(填“酸式”或“碱式”)滴定管;
(6)若要证明实验⑥中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,____________________________;
(7)为探究CuO在实验⑥中是否起催化作用,需补做如下实验(无需写出具体操作):a. __________________________________________,b. CuO的化学性质有没有改变。
27.(15分)
有机物A的相对分子质量为198.5,其结构简式如图I(R代表某种原子团)。已知在光照条件下,A分子中一个氢原子被氯原子取代只得到一种产物。A在一定条件下还有图II反应关系:
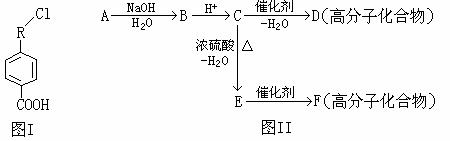
(1)请写出下列物质的结构简式
A______________________________ B_____________________________
(2)写出下列反应的化学方程式和指出其反应类型
C→D:________________________________________________________________;
反应类型:___________________________________
C→E:________________________________________________________________;
反应类型:___________________________________
E→F:________________________________________________________________;
反应类型:___________________________________
实验步骤:
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀;
③将步骤②所得混合物过滤、洗涤;
④将洗涤后的固体转移到蒸发皿,加热至沉淀全部变为黑色,冷却后研细备用。
回答下列问题:
(1)上述实验步骤中不需要使用玻璃棒的是_______(填实验序号),步骤①、④中研磨固体所用仪器的名称是_______;
(2)步骤③中洗涤沉淀的方法是_____________________;
(3)写出上述实验中有关反应的化学方程式(是离子反应的写离子方程式):
___________________________________________________________________________
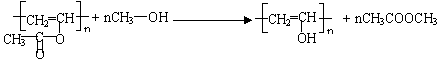
29.(共16分)⑴
 ⑵
⑵
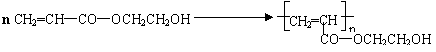
 ⑶
⑶
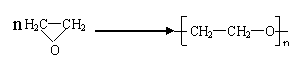
 ⑷
⑷
⑸ 加成反应, 中和反应、消去反应。
28.(共16分) ⑴分液漏斗,分液 (每空1分)
⑵取少量下层水溶液,滴加紫色石蕊试液,若溶 液变红,说明乙醛已被氧化(3分)
 ⑶ (3分)
⑶ (3分)
⑷(每空2分) ①使水蒸气冷凝回流, 防止H2SO4浓度变大,使乙醛炭化氧化
 ②易溶于水
及时将导气管撤离水面,防止发生倒吸现象
②易溶于水
及时将导气管撤离水面,防止发生倒吸现象
27.(l5分,每空3分)
⑴ AlO2- + NH4+ + 2H2O == Al(OH)3↓+ NH3·H2O
SiO32- + 2NH4+ + 2H2O == H2SiO3↓+2 NH3·H2O
S2- + 2NH4+ + ClO-+ H2O == S↓+ 2 NH3·H2O+ Cl-
⑵ Mg(OH)2 + 2 NH4+ == Mg2+ + 2 NH3·H2O
⑶ AlO2-
+ H+ + H2O 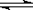 Al(OH)3
Al(OH)3  Al3+ + 3OH-
Al3+ + 3OH-
29. (共16分)已知:
(共16分)已知:
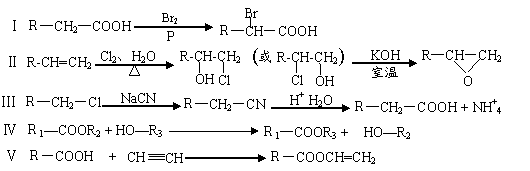
 下图是利用乙烯为主要原料合成多种高分子材料的流程图。
下图是利用乙烯为主要原料合成多种高分子材料的流程图。
⑴聚环氧乙烷(PEO)是环氧乙烷开环的聚合物,写出①反应的化学方程式 。⑵聚乙二醇(PEG)属多聚醚类,是原生质体融合的促融剂,写出②反应的化学方程式 。
⑶聚乙烯醇是婴儿纸尿片中能吸水保水的物质。写出③反应的化学方程式 。
⑷聚丙烯酸羟乙酯是具有良好透气性、亲水性和光学特性的隐身材料。写出④反应的化学方程式 。(以上反应条件不作要求)
⑸指出①、⑥反应的反应类型。① ,⑥ 。
答案:A D C A B B C C
 .26.(12分)⑴O2+2H2O+4e- == 4OH-
.26.(12分)⑴O2+2H2O+4e- == 4OH-
⑵FeCl3+3H2O Fe(OH)3(胶体)+3HCl
⑶1:104 ⑷H2(g) + 1/2O2(g) == H2O(I);△H=-285.8kJ/mol
28.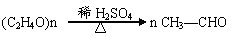
 (共16分)市售乙醛通常是40﹪左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为无色的水溶液。据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被空气中的O2所氧化。为了从变质的乙醛溶液中提取乙醛(仍是溶液),可利用如下反应原理:
(共16分)市售乙醛通常是40﹪左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为无色的水溶液。据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被空气中的O2所氧化。为了从变质的乙醛溶液中提取乙醛(仍是溶液),可利用如下反应原理:
请回答下列问题:
⑴先把混合物分离得到(C2H4O)n。将混合物放入 ,
静置,分离操作名称是 。
⑵设计一个简单的实验方案,证明乙醛在溶液中易被空气中的O2氧化。简明实验操作和现象 。
⑶若将乙醛滴入浓硫酸中,有黑色物质生成,写出有关反应的方
程式: 。
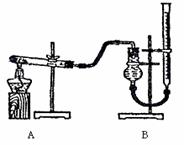
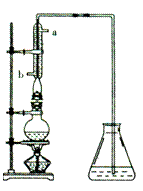
⑷右上图是提取乙醛装置图。烧瓶中是分离得到(C2H4O)n和6mol/LH2SO4的混合物,锥形瓶中是蒸馏水。加热至沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的蒸馏水中。
①用冷凝管的作用是 ,理由是 。
②锥形瓶内导气管口出现气泡,由下上升过程中体积越来越小,最后消失,说明乙醛具有
(性质)。当观察到气泡很少时,应急操作是 。
27.(l5分,每空3分)A、B、C、D分别为同一短周期元素,它们的原子序数递增,A的最高价氧化物对应水化物(甲)是一种白色难溶物,但可溶于NH4Cl和CH3COONH4浓溶液;B、C、D各有一种含氧酸的钠盐(正盐)乙、丙、丁溶液与(NH4)2S溶液反应,均有生成沉淀;B的最高价氧化物对应水化物(戊)受热分解产物是某天然红宝石的主要成分。请回答下列问题:
⑴依次写出乙、丙、丁溶液与(NH4)2S溶液反应产生沉淀的离子方程式
(乙) ;
(丙) ;
(丁) 。
⑵写出A的最高价氧化物对应水化物(甲)溶于NH4Cl和CH3COONH4浓溶液的离子方程式:
。
⑶写出B的最高价氧化物对应水化物(戊)在水中的电离方程式: 。
13.已知反应:2NO2(g) 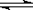 N2O4(g) △H== -57KJ/mol,在某容积不变的密闭容器中放入1mol的N2O4晶体,升高温度,维持恒温T℃,反应达到平衡时,混合气的平均相对分子质量
N2O4(g) △H== -57KJ/mol,在某容积不变的密闭容器中放入1mol的N2O4晶体,升高温度,维持恒温T℃,反应达到平衡时,混合气的平均相对分子质量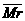 和N2O4的体积分数φ(N2O4)不再变化。平衡后,采取措施或改变条件,有关的说法错误的是 ( )
和N2O4的体积分数φ(N2O4)不再变化。平衡后,采取措施或改变条件,有关的说法错误的是 ( )
A.充入一定物质的量的N2O4,再次平衡后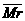 增大
增大
B.充入一定物质的量的NO2,再次平衡后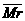 增大
增大
C.充入一定物质的量的Ar,再次平衡后φ(N2O4)增大
D.降低温度10℃后,再次平衡后φ(N2O4)增大
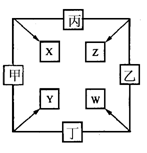 .26.(12分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中一种常见的金属。②常温下X是无色液体,Y是黑色固体。③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
.26.(12分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中一种常见的金属。②常温下X是无色液体,Y是黑色固体。③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
⑴丁在甲和X同时存在的条件下,可发生电化腐蚀,写出正极上的电极反应式: 。
⑵将少量W的饱和溶液滴入热的X中,反应的化学方程式是 。
⑶若Z、W两溶液的pH均等于5,则两溶液中由水电离出的H+的物质的量浓度之比为 。
⑷已知5.6L(标准状况)气体丙在甲中完全燃烧放出热量为71.45kJ,则能正确表示丙燃烧热的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com