
题目列表(包括答案和解析)
5. 浓度均为0.1mol/L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
A BaCl2 NaOH NaHCO3
B Na2CO3 MgCl2 H2SO4
C AlCl3 NH3·H2O NaOH
D Ba(OH)2 CaCl2 Na2SO4
4. 把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件通电一段时间后,析出钾、镁、铝的物质的量之比为
A 1:2:3 B 3:2:1 C 6:3:1 D 6:3:2
3. 用NA代表阿伏加德罗常数,下列说法正确的是
A 0.5molAl与足量盐酸反应转移电子数为1NA
B 标准状况下,11.2LSO3所含的分子数为0.5NA
C 0.1molCH4所含的电子数为1NA
D 46gNO2和N2O4的混合物含有的分子数为1NA
2. 下列叙述正确的是
A 同一主族的元素,原子半径越大,其单质的熔点一定越高
B 同一周期元素的原子,半径越小越容易失去电子
C 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D 稀有气体元素的原子序数越大,其单质的沸点一定越高
1. 在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A 分子晶体 B 原子晶体
C 离子晶体 D 何种晶体无法判断
29.(14分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL0.1mol/LFe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
27.(19分)碱存在下,卤代烃与醇反应生成醚(R-O-R‘):
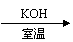
R-X+R‘OH R-O-R‘+HX
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
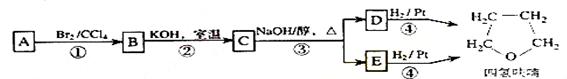
请回答下列问题:
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为
A分子中所含官能团的名称是 ,A的结构简式为 。
(2)第①②步反应类型分别为① ② 。
(3)化合物B具有的化学性质(填写字母代号)是
a可发生氧化反应 b强酸或强碱条件下均可发生消去反应
c可发生酯化反应 d催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:
C ,D和E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式:
。
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
。
28(19分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
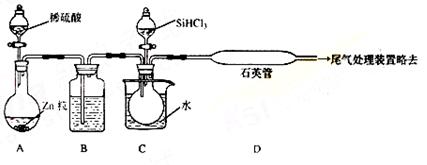
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是:
。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a碘水 b氯水 cNaOH溶液 dKSCN溶液 eNa2SO3溶液
26.(14分)中学化学中几种常见物质的转化关系如下:
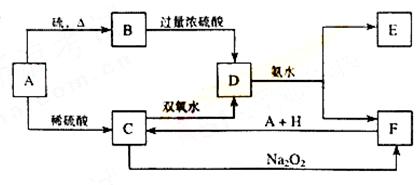
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
13.已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
12.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是
A.正极反应为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com