
题目列表(包括答案和解析)
10.已知某饱和溶液的以下条件:①溶液的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度。其中不能用来计算该饱和溶液的物质的量浓度的组合是 ( )
A.④⑤⑥ B.①②③④ C.①③④ D.①③④⑤
9.经测定某溶液中离子只有Na+、Ac-、H+、OH-四种,且离子浓度大小的排列顺序为:c(Ac-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是 ( )
A.该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B.0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Ac-)>c(Na+)>c(OH-)>c(H+)
D.该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
8.某溶液可能含有Na+、Ag+、A13+、AlO2-、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列结论中不正确的是 ( )
A.此溶液中一定有S2-、SO32-、Na+ B.此溶液中可能有AlO2-、CO32-
C. 此溶液中一定没有Ag+、A13+ D.此溶液中可能有S2-、NO3-
7.Al(OH)3是一种难溶于水的物质,只要溶液中Al3+物质的量浓度(mol/L)和OH‑物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为 ( )
A.1.9×10-33 B.2.7×10-11 C.8.7×10-8 D.1.2× 10-11
6.下列哪种物质的中心原子的最外层不是8电子结构 ( )
A.CO2 B.NF3 C.PF5 D.OF2
5.下列说法正确的是 ( )
A.Na2O2、Na2O均能吸收CO2并放出氧气
B.Mg、A1、Fe均能在冷的浓硝酸中钝化
C.SO2和C12的漂白原理相同
D.SiO2既能与NaOH又能与Na2CO3反应生成Na2SiO3
4.下列操作或实验数据记录正确的是 ( )
A.1mol/L的AgNO3溶液和1mol/L的KI溶液混合制碘化银胶体
B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液23.10mL
C.用pH试纸测得氯水的pH为2
D.在试管中制备Fe(OH)2时,将吸有NaOH溶液的滴管插入试管里FeSO4溶液的底部
3.痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,接触过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。则①②③的化学式是 ( )
A.①AgNO3 ②NaBr ③AgBr B.①AgNO3 ②NaCl ③AgCl
C.①AgCl ②AgNO3 ③NaCl D.①AgNO3 ②NaI ③AgI
2.过氧苯甲酸(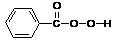 )与H2O2的分子结构中都有“
)与H2O2的分子结构中都有“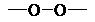 ”。过氧苯甲酸可作为食品漂白剂,但它能破坏食品中的维生素C(俗名抗坏血酸)、维生素E(俗名生育酚)等从而降低食品的营养价值,这个过程主要应是维生素C、维生素E等 ( )
”。过氧苯甲酸可作为食品漂白剂,但它能破坏食品中的维生素C(俗名抗坏血酸)、维生素E(俗名生育酚)等从而降低食品的营养价值,这个过程主要应是维生素C、维生素E等 ( )
A.酸性被中和 B.碱性被中和 C.被氧化 D.被还原
1.2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节的蛋白质降解机理。蛋白质降解时发生了 ( )
A.氨基酸的酯化反应 B.肽键的水解反应
C.碳氧键的断裂 D.碳氮键的断裂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com