
题目列表(包括答案和解析)
20.(8分)A是一种盐。它能发生下列转化(某些次要的生成物已略去)。其中B是红棕色固体,I是不溶于稀盐酸的白色沉淀,J是不溶于稀硝酸的浅黄色沉淀。

请回答下列问题:
(1) 写出B、D、J、I的化学式:
B , D , J , I ;
(2) 写出反应②的化学方程式,并注明反应条件:
;
(3) 工业上用水、氧气和黄铁矿作用制取A,同时得到E,写出此过程的化学方程式:
;
19.(6分)甲酸在浓硫酸存在下脱水可制得CO,碳酸可分解为H2O和CO2。目前已有文献报导碳还能形成其他一些氧化物,如:丙二酸在减压下用P4O10于140℃脱水可制得C3O2,它具有与CO2相似的线型结构,熔点-112℃,沸点6.7℃,室温下聚合成黄色液体。
(1) 根据以上信息可推知:C3O2在常温下为 (填状态),C3O2的结构简式为 ;C3O2是 分子(填“极性”或“非极性”)。
(2) 苯六甲酸(即苯分子中每个氢原子都被羧基取代生成的物质)完全脱水的产物也是一种碳的氧化物,它的分子式为 ,它的结构简式为 。
18.(6分)氢键可以表示为A-H…B,其产生的条件是A的电负性大,它强烈地吸引氢的电子云(或者说增强H的酸性),受体B具有能与酸性氢原子强烈地相互作用的高电子云密度区(如孤对电子)。
(1) 分子间形成的氢键会使化合物的熔、沸点 ;分子内形成氢键会使化合物的熔、沸点 。
(2) 在极性溶剂中,溶质和溶剂的分子间形成氢键会使溶质的溶解度 (填“增大”或“减小”);溶质的分子内形成氢键时,在极性溶剂中溶质的溶解度将 (填“增大”或“减小”);在非极性溶剂中溶质的溶解度将 (填“增大”或“减小”)。
(3) 由于形成氢键,氯仿在苯中的溶解度明显比1,1,1-三氯乙烷的大,请用文字或图示描述上述氢键 。
17.(10分)S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。
在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。

(1) 已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2) 装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;装置d的名称是 ,它的作用是 。
(3) 该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4) 图中f装置中应放置的试剂为 ,其作用为 。
16.(8分)实验室中制备正溴丁烷步骤如下:取正丁醇8g、NaBr 13g、浓硫酸15mL、水10mL,加热回流0.5小时,蒸出粗产物,再经洗涤、干燥等纯化步骤处理,最后蒸馏得到9.6g正溴丁烷。请回答:
(1) 理论产量应为_____g,实际产率是________%;
(2) 蒸馏得到的粗产物中,主要含有哪几种有机化合物 ;
(3) 反应过程中有白雾产生,其主要成份为 。如何确证?
。
15.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据
|
硫酸铜溶液 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
加入的无水硫酸铜(g) |
2.5 |
4.0 |
6.0 |
8.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
2.8 |
6.4 |
10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为 ( )
A.3.42g B.3.88g C.6.82g D.2.56g
14.恒温恒压下,在容积可变的密闭容器中发生反应:A(g)+B(g) C(g)。若开始时通入1molA和1mol B,达到平衡后生成α mol C,则下列说法错误的是 ( )
C(g)。若开始时通入1molA和1mol B,达到平衡后生成α mol C,则下列说法错误的是 ( )
A.若开始通入3mol A和3mol B,达到平衡后将生成3a mol C
B.若开始通入x mol A、2mol B和1mol C,达到平衡后密闭容器中有1mol A和3mol C,则x为3
C.若开始时通入4 mol A、2 mol B和1 mol C,达到平衡时,B的物质的量一定大于2mol
D.若开始时通入2molA、2 mol B和1 mol C,达到平衡后,再通入3 mol C,则再次到达平衡后,C的物质的量分数为a/(2-a)
13.硫-钠原电池具有输出功率较高、循环寿命长等优点。
其工作原理可表示为:2Na+xS Na2Sx。
Na2Sx。
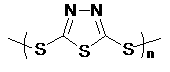 但工作温度过高是这种高性能电池的缺陷,科学家研究发现采用多硫化合物(如右图)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是 ( )
但工作温度过高是这种高性能电池的缺陷,科学家研究发现采用多硫化合物(如右图)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是 ( )
A.这是一种新型无机非金属材料
B.此化合物可能发生加成反应
C.原电池的负反应将是单体 转化为
转化为 的过程
的过程
D.当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g
12. 高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是 ( )
高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是 ( )
A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.超氧化钾的化学式为KO2每个晶胞含有14个K+和13个O2-
D.晶体中,0价氧原子与-2价氧原子的数目比可看作为3:1
11.下列离子方程式不正确的是 ( )
A.三氯化铝溶液中加人过量氨水 Al3++3OH- Al(OH)3↓
Al(OH)3↓
B.4mol/L的NaAlO2溶液和7mol/L的HCI等体积互相均匀混合
4AlO2-+7H++H2O 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液
5PbO2+2Mn2++4H+ 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L 25mL Na2CO3溶液中,并不断搅拌
2H++CO32- CO2↑+H2O
CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com