
题目列表(包括答案和解析)
28.(6分)将m mol Na2O2和n mol NaHCO3的固体混合物放在密闭容器中加热进行充分反应,并保持250℃。
(1) 随m/n值的变化,残留固体和气体的成分也发生相应的变化,若氧气和水蒸汽的物质的量相等,则m/n的值是多少?
(2) 试确定混合气体平均相对分子质量的范围。
27.(6分)吗啡和海洛因都是严格查禁的毒品。
(1) 吗啡分子含C 71.58%、H 6.67%、N 4.91%,其余为O。已知其相对分子质量不超过300。试求:
① 吗啡的相对分子质量。
② 吗啡的分子式。
(2) 已知海洛因是吗啡的二乙酸酯。试求:
① 海洛因的相对分子质量。
② 海洛因的分子式。
26.(8分)用H2C2O4·2H2O滴加浓H2SO4制备CO,通入灼热的Fe2O3粉中,做炼铁实验。但此法制备的CO中含有其他气体,必须除去。现有下列装置:
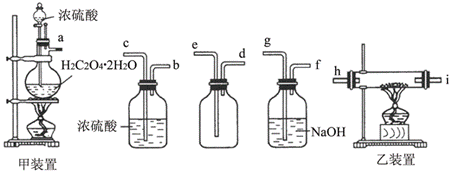
根据题目要求,回答下列问题:
(1) 写出H2C2O4·2H2O跟浓硫酸反应的化学方程式。
。
(2)用a-h表示连接顺序,将装置连接正确 。
(3) 用A ~ F正确表示下面实验操作的先后顺序:
A.点燃甲装置的酒精灯,打开分液漏斗,调节浓硫酸的滴速。
B.点燃乙装置中的酒精灯,加热氧化铁。
C.检查整套装置的气密性。
D.将导管口i处的尾气加以处理。
E.乙装置玻璃内的Fe2O3变黑时,熄灭乙装置中的酒精灯。
F.关好甲装置中分液漏斗的开关后,再熄灭该装置中的酒精灯。
(4) 空洗气瓶的作用是 ,浓硫酸洗气瓶的作用是 。
(5) 处理i处的尾气,应采用的简单而有效的方法是 。
25.(8分)工业上采用湿法炼锌过程中, 以ZnSO4为主要成分的浸出液中,有Fe3+、Fe2+、Sb3+、Cu2+、Cd2+、Cl-等杂质,这些杂质对下一道锌的电解工序有妨碍,必须事先除去。现有下列试剂:
① KMnO4;②NaOH;③ZnO;④H2O2;⑤Zn;⑥Fe;⑦AgNO3;⑧Ag2SO4;⑨H2SO4
根据要求将合适的试剂的序号填入下面的空格:
(1) 用 将Fe2+离子氧化成Fe3+离子,相应的离子方程式为 。
(2) 用 调节浸出液的pH = 5.2时, 、 等形成氢氧化物沉淀,同时也有 沉淀生成。
(3) 用 除去Cu2+和Cd2+离子。
(4) 用 除去Cl-离子。
24.(7分)研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
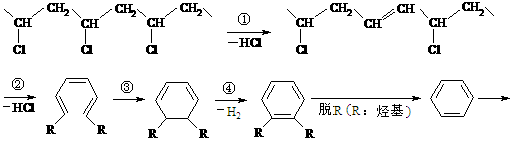
请回答下列问题:
(1) 火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,在火灾现场,为防止气体中毒的防护措施是 。
(2) 上述变化中①所属的反应类型为 ;有机化学中将分子加氧或去氢的反应称为氧化反应,加氢去氧的反应称为还原反应,据此,上述反应中属氧化反应的是(填代号) 。
(3) 在装修中广泛使用的粘合剂也是极易发生火灾的物质,聚乙烯醇缩丁醛就是这样一种粘合剂,它是由聚乙烯醇(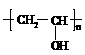 )与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO → CH3OCH2OCH3+H2O可以发生。请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:
。
)与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO → CH3OCH2OCH3+H2O可以发生。请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:
。
23.(3分)在某条件下,容器有可逆反应A+4B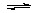 2C+D;△H <0,达平衡状态时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
2C+D;△H <0,达平衡状态时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
(1) 改变a的取值,再通过改变反应条件,可以使反应重新达到平衡,并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围为 (用a和d的关系式表示) 。
(2) 如果要使在本反应重新建立的平衡中,D的物质的量只允许在d到2d 之间取值,则应采取的措施是 (从下面列出的选项中选择)。
A.升高反应温度;B.增大反应容器内的温度;C.增大反应容器的体积;D.降低反应的温度;E.减小反应容器的压强;F.减小反应容器的体积;
22.(5分)用32%~35%的FeCl3溶液腐蚀印刷线路板的废液中含有FeCl3 、FeCl2和CuCl2。
(1) 若用电化学方法使废液再生,则两极上的电极反应分别为: 。
(2) 回收铜的化学方法为 。
(3) 回收铜以后的溶液如何利用? 。
21.(7分)“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。若产生的气体为N2O,稀硝酸腐蚀锌版反应的主要化学方程式是 。“烂版液”的主要成分是 和由自来水带进的Cl-、Fe3+等杂质离子。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,用pH试纸检验,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2,将溶液小心加热,冷却后即得到ZnSO4·7H2O晶体。
在操作①中保持pH=8的目的是 。Cl-、NO3-是在操作 中除净的。操作③中加热的目的是 。Fe3+是在操作 中除去的。操作④保持pH=2的目的是 。操作④中所用的主要仪器是 。
20.(4分)硫酸(H2SO4)分子的结构式为,请你仿照此结构画出下列酸的结构: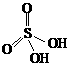 ;亚硫酸(H2SO3)
;焦硫酸(H2S2O7) ;过硫酸(H2S2O8)
。这四种酸中酸性最弱的是
。
;亚硫酸(H2SO3)
;焦硫酸(H2S2O7) ;过硫酸(H2S2O8)
。这四种酸中酸性最弱的是
。
19.(5分)A是氮、氢两种元素组成的化合物。A与氨结构之间的关系类似于过氧化氢和水结构之间的关系。一个A分子含两个氮原子。请填写以下空白:
(1) A的分子式是 。
(2) A的水溶液呈 (填酸、碱、中)性,1mol A最多可与 mol HCl发生中和反应形成正盐。写出形成的盐中含有氮原子的离子的电子式: 。
(3) A在氧化还原反应中也与过氧化氢相似,既可作氧化剂,又可作还原剂。请从化合价的角度分析产生这种情况的原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com