
题目列表(包括答案和解析)
3.设NA代表阿伏加德罗常数,下列说法中正确的是
A.2L 1mol/L(NH4)2SO4溶液中含2NA个NH4+
B.SiO2晶体中,与每1molSi原子结合形成共价键的O原子数为4NA
C.在标准状况下,1L辛烷完全燃烧,可产生8NA /22.4L二氧化碳
D.常温常压下,1mol氖气中含有NA个氖原子
2.(2001年上海)设NA为阿伏加德罗常数,下列说法不正确的是:
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46gNO2和46gN2O4含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
微粒数

NA ÷
× NA
 ÷摩尔质量
22.4L·mol-1÷
÷摩尔质量
22.4L·mol-1÷


 质量
物质的量
体积[气体体积(标准状况)]
质量
物质的量
体积[气体体积(标准状况)]
摩尔质量× (mol) ×22.4L·mol-1
 ÷ 溶液
÷ 溶液
溶液 体积
体积 ×
浓 度[物质的量浓度(mol/L)]
记忆方法:上微粒、下浓度,质量、体积分左右,中间就是摩尔(数)
向下、向内都用除 反之相乘得各数
注意点:
①一个中心:必须以物质的量为中心
②两个前提:在应用Vm=22.4L·mol-1时,一定要有“标准状况”和“气体状态”为两个前提。
③三个条件:★直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;★摩尔质量与相对分子质量间的关系;
★“强、弱、非”电解质与溶质粒子(分子、或离子)数间的关系。
④四个无关:★物质的量、质量、粒子数的多少与温度、压强的高低无关
★物质的量浓度的大小与所取溶液的体积多少无关
(但溶质粒子数的多少与溶液体积有关)
⑤状态问题:水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;碳原子数大于4的烃,在标准状况下为液态或固态。
⑥特别物质的摩尔质量:D2O、T2O、18O2等
⑦某些物质分子中的原子个数:Ne、O3、白磷等。
⑧一些物质中的化学键数目:SiO2、Si、CH4、P4、CO2等。
⑨某些离子或原子团在水溶液中发生水解反应,使离子数目减少
⑩较复杂的反应中,转移电子数的计算:Na2O2+H2O、Cl2+NaOH、电解AgNO3溶液等。
[典型例题]
1.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积
是(式中NA代表阿伏加德罗常数)
A.22.4bc/(aNA)L B.22.4ab/(cNA)L C.22.4ac/(bNA)L D.22.4b/(acNA)L
|
量的名称 |
符号 |
单 位 |
涵 义 |
说 明 |
|
相对原子质量(原子量) |
Ar |
国际单位制 (SI) 单位为1 |
元素的一个原子的质量对碳-12原子质量的1/12之比 |
原子的质量、质量数均不同于原子量 |
|
相对分子质量(化学式量) |
Mr |
同上 |
化学式中各原子的相对原子量和其原子数的乘积之和 |
通常用分子量表示 |
|
物质的量 |
n |
摩尔(mol) |
摩尔是表示物质的量的单位。每摩尔物质含有阿伏加德罗常数个微粒。 |
微观粒子包括原子、分子、离子、电子等以及它们的特定组合 |
|
摩尔质量 |
M |
g/mol |
1摩尔物质的质量 |
数值上等于该元素的原子量或物质的化学式量 |
|
气体摩尔体积 |
Vm |
L/mol |
在标准状况下(0℃, 101.3kPa),1mol任何气体的体积都约为22.4L。 |
Vm的大小与温度和压强有关 |
|
物质的量浓度 |
C |
mol/L |
1L溶液中含有溶质的物质的量 |
|
2. 气体摩尔体积
①等物质的量的液体、固体体积大小--主要决定于构成它们微粒的大小,而温度、压强对其体积大小几乎没有影响。
②等物质的量气体体积大小--主要决定于分子间的平均距离,因为通常情况下,分子间的平均距离是分子直径的10倍左右,而分子间的平均距离的大小由温度和压强决定,温度升高或压强减小,平均距离增大,反之减小。但只要是在同温同压下,任何气体分子间的平均距离相等。
③气体摩尔体积--1摩(等物质的量)的任何气体(单质、化合物、混合物等,只要是气体)所占的体积(一定温度和压强)。
在标准状况下(0℃,1.01×105Pa),1摩尔任何气体的体积都约是22.4升。
1.物质的量
①物质的量物理意义:衡量宏观物质的质量和微观结构粒子多少(分子、原子、离子、中子、质子、电子)的物理量,它是七个国际单位制物理量中的一个(质量、长度、时间、电流强度、热力学温度、光学强度)。其单位是摩尔(mol)。
②阿伏加德罗常数(NA)就是0.012KgC-12所含的碳原子数,由此可以看出:
★阿伏加德罗常数是一个精确值(0.012Kg C-12含碳的原子数是个定值)
★ 阿伏加德罗常数可通过实验测定(测定方法有: ;
; 。)
★6.02×1023是个非常近似的值。
③摩尔质量--单位物质的量的物质所具有的质量,即M=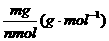
摩尔质量与式量(相对分子质量、相对原子质量)的关系:
摩尔质量是指每摩尔物质微粒(分子、原子、离子、中子、质子、电子及其它粒子,或这些粒子的特定组合)的质量,其单位是g·mol-1;而式量(相对分子质量、相对原子质量)是一种相对比值,单位为1。摩尔质量与式量的意义不同,但在数值上等于其式量。
④引入摩尔的意义:摩尔象一座桥梁把单个的肉眼看不见的微粒跟很大数量的微粒集体,可称量的物质之间联系起来。
9. 某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
图6中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:
(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):
。
(2)装置C中放入的反应物是 和 。
(3)装置A的作用是 。装置B的作用是 。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意 和 (填写字母编号)。
a. 视线与凹液面最低处相平。
b. 等待片刻,待乙管中液面不再上升时,立刻读数。
c. 读数时应上下移动乙管,使甲、乙两管液面相平。
d. 读数时不一定使甲、乙两管液面相平。

图6

8. 实验室里在制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如图5所示的装置(1)。并设想用(2)或(3)两种简易装置代替(1)中的b~c部分,以求达到同样的目的。
试回答:
(1)若用(1)制取氯气,b瓶中宜加入的液体一般为 。在选取试剂正确且适量的前提下,反应开始后,当关闭活塞时发现c中液面不明显上升,估计可能的原因是 。检查原因的简单方法是 。
(2)若有(1)中用 固体
固体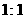 的硫酸制取
的硫酸制取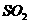 气体,通常可以对(1)中制气装置进行怎样的简单改动? 。b中的液体一般应选用
。
气体,通常可以对(1)中制气装置进行怎样的简单改动? 。b中的液体一般应选用
。
(3)装置(1)中b瓶能防止多余气体逸散的原因是(简要回答) 。
(4)用(2)或(3)代替(1)中的b~c部分,是否可行? ,简要说明理由: 。

图5
7. 图4表示在没有通风橱收集纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是 ;其作用是 ,水槽中应盛放的液体是 。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应 ;当氯气纯度合乎要求时,应 ;当氯气收集完毕时,应 。
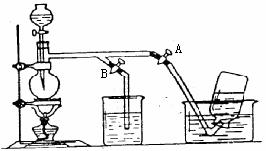
图4
6. 检验集气瓶Z是否集满气体,置于瓶口的滤纸应沾上的溶液是( )
A. 氯化钡溶液 B.
酸性 溶液
溶液
C. KI淀粉溶液 D. 澄清石灰水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com