
题目列表(包括答案和解析)
7.某酸雨的成分经检测,除含有少量H+和极少量的OH-外,还含有[SO42-]=2.5×10-6mol/L,[Cl-]=3.5×10-5mol/L,[NH4+]=2.3×10-5mol/L,[Na+]=7.0×10-6mol/L。则此次酸雨的pH值接近于 。
6.在VL Al2(SO4)3溶液中加入过量的氨水,过滤得沉淀,然后高温灼烧沉淀,最后得到白色固体bg,则原溶液中SO42-的物质的量浓度为 。
5.在Na2S溶液中存在多种离子和分子,下列关系式正确的是( )
A.[OH-]=[HS-]+[H+]+[H2S] B.[OH-]=2[HS-]+[H+]+[H2S]
C.[OH-]=[HS-]+[H+]+2[H2S] D.[OH-]=[HS-]+[2[H+]+[H2S]
4.Fe与Fe2O3的混合物2.72g,加入到50mL 1.6mol/L盐酸中恰好完全反应,经KSCN检验,溶液不显红色,若忽略溶液体积变化,则溶液中Fe2+物质的量浓度是( )
A.0.2mol/L B.0.4mol/L C.0.8mol/L D.1.6mol/L
3.在体积为VL的密闭容器中,通入amolNO和bmolO2,反应后容器内氮原子数和氧原子数之比为()
A.a/b B.a/2b C.a/(a + 2b) D.a/[2(a + b)]
2.将Na2CO3和NaHCO3混合物100g,加热使NaHCO3完全分解后,残留物为94g,求原混合物中钠的质量分数。
1.标准状况时,0.1mol烃和1molO2(过量)混合,完全燃烧后,通过过量的Na2O2固体,固体增重15g,从Na2O2中逸出的全部气体为16.8L,求该烃的分子式。
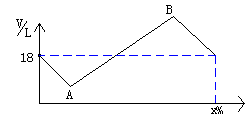
27.NH3和Cl2可迅速发生如下反应:
2NH3+3Cl2=N2+6HCl.附图为反应后
气体总体积V随该混合气体中Cl2
的体积含量(x%)而变化的图象
(每次实验取气体的总量均为18L)试计算
(1)当反应处于B点时(结束后)原混合气体中Cl2体积百分含量是多少?
(2)当反应结束处于A点时所得气体的总体积是多少升?
(3)当反应结束时,V=6L,则原混合气体中Cl2的体积百分含量为多少?
25.0g CuSO4·H2O均匀加热,缓慢升温至1000℃,并恒温一段时间。
试通过计算回答下列问题: (1)反应过程中固体产物的质量是否可以为10g(填“可能”或“不可能”) ; (2)若实验无误差,反应完全后,气体产物除去水后,其物质的量n(气体)的
取值范围为 ; (3)某同学在实验最后获得固体质量为7.6g,试计算该同学获得固体物质的组成
成分和它们的质量。
26.加热硫酸铜晶体,随着温度不断升高到1000℃,晶体会逐渐“释放”水蒸气、
三氧化硫(并会分解)、氧气,同时生成CuO,而最后CuO转化为Cu2O,现将
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com