
题目列表(包括答案和解析)
25.(6分)有机物A和B由C、H、O三种元素组成,两者互为同系物,且知A分子的碳原子数较B分子少,A的相对分子质量不超过70。
现有等物质的量A和B的混合物,其中氧的质量分数为16/51。取一定量该混合物,与一定量的氧气混合点燃,在120℃ 101 kPa的条件下,将燃烧产物通入足量浓硫酸,气体体积减少为原来的二分之一;再将剩余气体通入碱石灰,气体全部被吸收。
(1)该混合物的平均相对分子质量为________;
(2)A的分子式为________,B的分子式为________。
24.(10分)乳酸是酸奶的成分之一,乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。利用乳酸可以合成多种具有生物兼容性和环保型的高分子材料。乳酸已成为近年来人们的研究热点之一。乳酸的结构简式为CH3CH(OH)COOH,以下是采用化学方法对乳酸进行加工处理的过程:
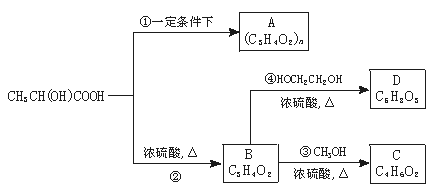
请根据乳酸的性质和上述信息填写以下空白:
(1)写出乳酸与NaOH溶液反应的化学方程式:________________________________。
(2)写出乳酸与硫酸共热生成C6H8O4的化学方程式:__________________________。
(3)②的反应类型是________;化合物A的结构简式是__________________________。
(4)作为制作隐形眼镜的材料,对其性能的要求除应具有良好的光学性能外。还应具有良好的透气性和亲水性。采用化合物D的聚合物而不是化合物C的聚合物作为隐形眼镜的制作材料的主要原因是________________________。请写出由化合物D合成高分子化合物的反应方程式:____________________。
23.(10分)0.1 mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后,生成的二氧化碳完全被300 mL 2 mol·L-1的氢氧化钠溶液吸收。所得溶液中含有两种物质的量相等的溶质。
(1)若为纯净物,试推断可能的烯烃分子式:
①________;②________;③________。(可以不填满,也可以补充)
(2)若为两种烯烃的混合物,试推断可能的组成及体积比(可以不填满,也可以补充):
|
序号 |
组成 |
体积比 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
22.(11分)A、B、C、D为常见的单质,E、F、G为熟悉的化合物。A、B为气体,C、D为固体,E为黑色固体,D、F均为淡黄色粉末,G为暗红色粉末。有关物质间转化关系如图所示(其他产物均已略去)。
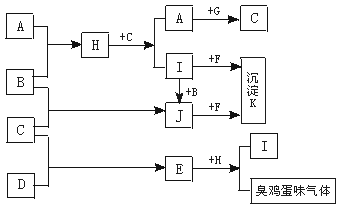
(1)写出下列物质的化学式:F________、G________、K________。
(2)写出下列反应的化学方程式:
①A+B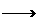 H__________________________。
H__________________________。
②C+D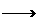 E__________________________。
E__________________________。
(3)写出下列反应的离子方程式:
①I+B J________________________________。
J________________________________。
②H+C A______________________________。
A______________________________。
21.(6分)燃放鞭炮会对环境产生危害,同时也会对人造成一定的危险。因此我国一些地区规定禁止燃放鞭炮。黑火药是制造鞭炮的主要原料,其成分是硝酸钾、硫磺和木炭。若爆炸时产生硫化钾、二氧化碳和氮气。
则根据上述内容填空:
(1)写出黑火药爆炸时所发生的化学反应方程式:____________________。
(2)在这个反应中,被还原的元素是____________,氧化产物是________。
(3)当有3.6 g碳完全反应时,可生成气体的体积在标准状况下是_______L。这些气体若在1.01×105 Pa的压强和200℃的条件下的体积将是_________L。
20.(16分)环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含
CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O以及Cl-。其离子反应方程式为:CN-+
ClO- CNO-+Cl-,2CNO-+3ClO-+2H+===N2↑+2CO2↑+3Cl-+H2O。某科研部门用下图装置进行模拟实验,以证明上述处理含CN-污水方法的有效性,并测定CN-被处理的百分率。下述实验装置是通过测定CO2的量来确定CN-的处理效果。
CNO-+Cl-,2CNO-+3ClO-+2H+===N2↑+2CO2↑+3Cl-+H2O。某科研部门用下图装置进行模拟实验,以证明上述处理含CN-污水方法的有效性,并测定CN-被处理的百分率。下述实验装置是通过测定CO2的量来确定CN-的处理效果。
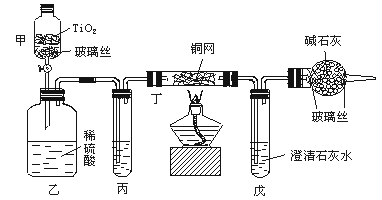
试根据要求回答下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:________________。
②丙中加入的除杂试剂是______________________。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁在实验中的作用是____________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________80%(填“>”“=”“<”)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出二点即可):____________________。
19.(8分)下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
|
华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 化素片(西地碘片)的主要活性成分是分子碘,含是1.5 mg/片。 将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在凉处保存。 [有效期]二年 |
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是__________(写分子式);
②请推断华素片__________(“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向该试管中再加入约2 mL______(填选项字母),并用力振荡;
A.酒精 B.热裂汽油
C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象____________________________;
③选用该液体做实验的原因是____________________________________。
(3)请再设计另一种方法,验证华素片中的成分,(注意叙述实验原理、操作方法和实验结论)__________________________________________________________________________。
18.室温时,向体积均为1 L pH为2的盐酸中分别加入0.02 mol金属M,反应完毕后再分别加入0.01 mol N。则两次加入金属的全过程中,放出气体最多的是
|
|
A |
B |
C |
D |
|
第一次加入M |
K |
Na |
Zn |
Mg |
|
第二次加入N |
Al |
Mg |
Al |
Na |
第卷(非选择题 共76分)
17.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,它具有容量大的特点,其电池反应为2Zn+O2===2ZnO,其原料为锌粉、电解液和空气。则下列叙述正确的是A.锌为正极,空气进入负极
B.负极反应为Zn-2e-===Zn2+
C.电解液肯定不是强酸
D.正极发生氧化反应
16.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O与上述反应在氧化还原反应原理上相似的是
A.SO2+2H2O===3S+2H2O
B.CaCO3+H2O+CO2===Ca(HCO3)2
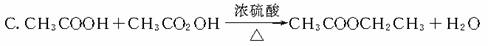
D.2FeCl3+Fe===3FeCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com