
题目列表(包括答案和解析)
15.(9分)下图是中学化学中常见的物质间化学反应关系图示,其中未注明用量的物质间的反应均按恰好充分反应处理,其它有关信息已在框图中说明:
 加少量BaCl2溶液
加少量BaCl2溶液
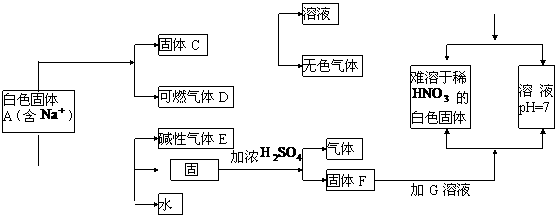
 加白色粉末
加白色粉末
△
加白色固体B
 △
微热
△
微热
(1)写出下列物质的化学式:
A: B: D: E: F: C:
(2)写出下列反应的化学方程式:
A D气体:
。
D气体:
。
(3)白色固体B的化学式是否能确定 (填是或否),
理由是 。
14.(8分)实验室里用加热正丁醇,溴化钠和浓H2SO4的混合物的方法来制备1–溴丁烷时,还会有烯、醚和溴等副产物生成。反应结束后将反应混合物蒸馏,分离得到1–溴丁烷,已知有关的有机物的性质如下表:
|
|
熔点/℃ |
沸点/℃ |
密度/ |
|
正丁醇 |
–89.53 |
117.25 |
0.81 |
|
1–溴丁烷 |
–112.4 |
101.6 |
1.28 |
|
丁醚 |
95.3 |
142 |
0.76 |
|
1–丁烯 |
–185.3 |
–6.5 |
0.59 |

(1)生成1–溴丁烷的反应化学方程式是 。
(2)反应中由于发生副反应而生成副产物的反应类型有 。
(3)生成1–溴丁烷的反应装置应选用上图中的 (填序号);反应加热时的温度应控制在 100℃(填< 、>或=)。
(4)反应结束后,将反应混合物中1–溴丁烷分离出来,应选用的装置是 ,该操作应控制的温度范围是 。
(5)在最后得到1–溴丁烷的产物中,可能含有的杂质主要是 ,将其进一步除去的方法是 。
13.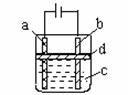 (7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用右图电解实验可以制得白色的纯净的Fe(OH)2沉淀。两电极材料分别为石墨和铁。
(7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用右图电解实验可以制得白色的纯净的Fe(OH)2沉淀。两电极材料分别为石墨和铁。
(1)a电极材料应为 ,电极反应式为 。
(2)电解液C可以(填编号)是 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对C应作何简单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号) 。
A、改用稀硫酸作电解液 B、适当增大电源的电压
C、适当减小两电极间的距离 D、适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一现象是 。
12.(13分)现有分子式均为CaHbNcOd的A、B两种有机物。
(1)有机物A是天然蛋白质的水解产物,光谱测定显示:A的分子结构中不存在甲基(-CH3)。一定条件下,两分子A发生缩合反应生成M和一分子水,M的相对分子质量为312。A分子间还可通过缩聚反应得到N。
①请将A、M和N的结构简式填入相应的方框中。

②已知氨基酸在水溶液中存在如下平衡:
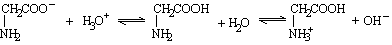
现有A的水溶液,若向其中加入盐酸,则平衡向__________方向移动;有机物____________的浓度增大。若向A溶液中加入氢氧化钠溶液,则平衡向___________方向移动;有机物____________的浓度增大。
(2)化合物B是某种分子式为 CaHb+1的芳香烃一硝化后的唯一产物(硝基连在苯环上),
则化合物B的结构简式为:_______________________。
化合物A和B互为______________;其中___________是与生命起源有关的物质。
11.(10分)A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录(见下图),其中H、G均为不溶于酸的白色沉淀。
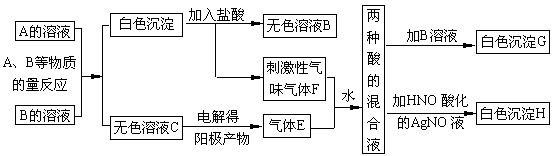
(1)写出A、B两种盐的化学式A___________B___________。
(2)写出A、B反应的离子方程式_______ ____________。
(3)写出F+E+H2O反应的化学方程式 。
(4)电解C的无色溶液,阴、阳两极所得气体的体积比理论值为1∶1,而实际收集到的气体的体积比却大于1∶1,简单解释原因__________ ________。
10.(6分)某课外活动小组做了一个有趣的试验:将2 g铝粉和3 g碘粉小心混合均匀,分为质量相等的3份,分别进行如下实验,现将实验纪录列表如下
|
第一组 |
加入0.5 g水 |
很快产生火花 |
|
第二组 |
加入1 g胆矾 |
约需30秒产生火花 |
|
第三组 |
加入1 g无水硫酸铜 |
1分钟时仍无明显现象 |
根据上述事实回答下列问题:
(1)上述实验中,发生反应时除产生火花外还应有什么现象?_____ _____
(2)通过上述实验说明了什么问题?____________ ________________
(3)写出发生反应的化学方程式:____________ __________________
9.
在体积、温度都相同的条件下有下列反应:2A(气)+2B(气)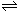 C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
(
)
C(气)+3D(气)。现分别从两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
(
)
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vB
D.达平衡时,Ⅰ途径所得混合气的密度与Ⅱ途径所得混合气密度相等
8.取100mL18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体在标况下占有的体积为22.4L。将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为 ( )
A.1:2 B.2:1 C.1:4 D.1:4
7.在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中Ba2+恰好完全沉淀时,测得溶液的pH=2。若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是 ( )
A.10:1 B.1:9 C.1:10 D.9:1
6..超导材料为具有零电阻及反磁性物质,以Y2O3、BaCO3和CuO为原料、经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5mol此高温超导物,依化学剂量比例,需取Y2O3、BaCO3和CuO的物质的量分别为 ( )
A.0.50、0.50、0.50 B. 0.25、1.0、1.5
C.0.50、1.0、1.5 D.1.0、0.25、0.17
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com