
题目列表(包括答案和解析)
8.在室温下,某浓度的氯化铵溶液的pH为4,下列说法中正确的是 ( )
①由水电离出的H+浓度约为1×10-10mol·L-1
②溶液中(CI-)>(NH4+)>(H+)>(OH-)
③溶液中(CI-)>(NH4+)>(OH-)>(H+)
④溶液中(H+)·(OH-)=1×10-14
⑤溶液中水的电离度约为1.8×10-4%
A.①② B.④⑤ C.①③⑤ D.②④⑤
7.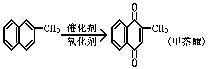 甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,其反应方程式如右图所示:
甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,其反应方程式如右图所示:
在某次合成反应中,用1.4g(0.01mol)的α-甲基萘,才制得0.17g(0.001mol)甲萘醌,已知该反应的速率是快的。试判断导致其产率低的原因是 ( )
A 使用了过量的催化剂 B 没有用乙酸,而是使用其它催化剂
C 把反应混合物加热 D 所生成的甲基醌是沉淀物
6.NiO晶体在氧气中加热,部分Ni2+被氧化成Ni3+成为NixO(x<1).该晶体为NaCl型晶体,组成晶体基本单位是立方体.每个立方体中含4个NixO分子,今有一批NixO晶体,测得其密度为6.47g/cm3,立方体边长为4.157×10-8cm,则NixO的式量是 ( A)
A.70 B.280 C.75 D.45
5.多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是 ( ) A.5 B.4 C.3 D.2
4.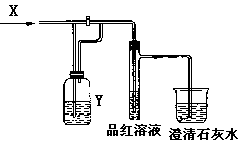 右图是一套检验气体性质的实验装置,向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y分别可能是
( )
右图是一套检验气体性质的实验装置,向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y分别可能是
( )
|
|
A |
B |
C |
D |
|
X |
SO2 |
H2S |
CO2 |
Cl2 |
|
Y |
饱和NaHCO3溶液 |
浓硫酸 |
Na2SO3溶液 |
Na2CO3溶液 |
3.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) ( )
(1) G®Q + NaCl
(2) Q + H2O X + H2
X + H2
(3) Y + NaOH®G+Q+H2O (4) Z+NaOH®Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是
A.QGZYX B.GYQZX C.GYZQX D. ZXGYQ
2.以下现象与电化腐蚀无关的是 ( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
1.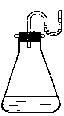 把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)如右图所示,则加入的物质可能是 ( )
把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)如右图所示,则加入的物质可能是 ( )
① NaOH固体 ②18 mol/L H2SO4溶液 ③ NH4NO3晶体
④Na2O2固体 ⑤生石灰
A. ①②④⑤ B. ①②③ C. ②③⑤ D. ③④⑤
17.(11分)在一定温度下,难溶电解质AmBn在水中可建立如下平衡:AmBn(s) mAn++nBm-,在一定温度下,当达到溶解平衡时,c(An+)m·c(Bm-)n为一个常数,用Ksp表示。在一定温度下,当c(An+)m·c(Bm-)n
=Ksp时溶液达到饱和,沉淀量既不增加也不减少;当c(An+)m·c(Bm-)n >Ksp时,将析出沉淀;当c(An+)m·c(Bm-)n<Ksp时,沉淀将溶解。根据上述原理计算:
mAn++nBm-,在一定温度下,当达到溶解平衡时,c(An+)m·c(Bm-)n为一个常数,用Ksp表示。在一定温度下,当c(An+)m·c(Bm-)n
=Ksp时溶液达到饱和,沉淀量既不增加也不减少;当c(An+)m·c(Bm-)n >Ksp时,将析出沉淀;当c(An+)m·c(Bm-)n<Ksp时,沉淀将溶解。根据上述原理计算:
(1)已知在常温下,FeS的Ksp=6.25×10-18,计算该温度下FeS的溶解度。(设溶液的密度为1.0 g/mL)
(2)又知H2S的饱和溶液中存在着以下关系:
c(H+)2· c(S2-)=1.0×10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1.0 mol/L,应调节溶液的pH为多少?(已知lg2≈0.3)
16.(6分)用铂电极电解含有一定量重水(D2O)的水,在阴极收集到的气体中将含有H2、HD和D2。电解1 L含重水0.017%(质量分数)的水(设其密度为 1 g/cm3),将阴极所得气体分离得到HD和D2,已知分离后所得气体的平均相对分子质量为3.5,求这种气体在标准状况下的体积为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com