
题目列表(包括答案和解析)
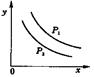
11.反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a<b
10..利用天然气合成氨的工艺流程示意如下:
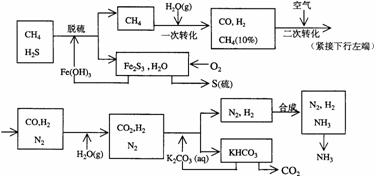
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
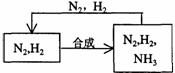
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
(1)3H2S+2Fe(OH)3→Fe2S3+6H2O (2)27n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
1.(1)0.013 (2)0 催化剂 (3)> > (4)由吸热温度升高时,平衡向右移动
9.某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
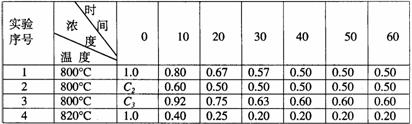
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
8.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(气)+B(气)=2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
7.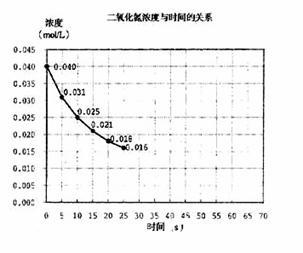 二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的吗线表示二氧化氮分解反应在前25秒内的反应进程。
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的吗线表示二氧化氮分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均生成速度:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。
 (4)写出该反应的化学平衡常数表达式:____________
(4)写出该反应的化学平衡常数表达式:____________
(1)5.5×10-4mol·L-1·s-1(2)图中实践
(3)图中虚线
(4)k=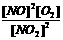
6. 对于反应2SO2+O2
对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
4.下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间 t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm NiO层厚Y′/nm |
0.05a b |
0.20a 2b |
0.45a 3b |
0.80a 4b |
1.25a 5b |
*注:a和b均为与温度有关的常数
请填空回答:
⑴金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
。
⑵金属氧化膜的膜厚Y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚Y属 型,NiO氧化膜厚Y′属 型。
⑶Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性: ,其理由是:
。
⑴反应速率可以用反应物的消耗速率,也可以用产物的生成速率。⑵直线,抛物线⑶Ni,它的腐蚀速率随时间的增长比镁的要慢。
5同温同压下,当反应物分解了8%时,总体积也增加8%的是
 A.2NH3(g)
? N2(g)+3H2(g)
A.2NH3(g)
? N2(g)+3H2(g)
 B.2NO(g) ? N2(g)+O2(g)
B.2NO(g) ? N2(g)+O2(g)
 C.2NO3(g) ? 4NO2(g)+O2(g)
C.2NO3(g) ? 4NO2(g)+O2(g)
 D.2NO2(g) ? 2NO(g)+O2(g)
D.2NO2(g) ? 2NO(g)+O2(g)
3. 某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气) 2C(气)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占40%,则下列推断正确的是
某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气) 2C(气)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占40%,则下列推断正确的是
A.原混合气体的体积为1.1V B.原混合气体体积为1.2V
C.反应达到平衡时,气体A消耗了0.2V D.反应达到平衡时,气体B消耗了0.2V
2. 已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com