
题目列表(包括答案和解析)
26.在一体积固定的密闭容器中,充入一定物质的量的NO和O2,充分反应。测得反应后容器内气体对相同条件下的氢气相对密度为23。
⑴写出容器内发生反应的化学方程式。
⑵计算反应后容器内气体的组成。
⑶维持容器温度不变,再向容器内充入一定物质的量的O2,分析容器内气体对氢气的相对密度将发生什么样的变化。
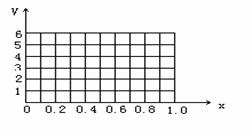
25.有丙炔和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体的体积为VL(所有体积均在同温同压下测定)。
(1)若将上述5L气体在氧气中完全燃烧生成二氧化碳和水,消耗同温同压下氧气的体积V(O2)的取值范围为 ;
(2)若氢气的体积为1L,反应后的体积V= L。
(3)若氢气在混合气体中的体积分数为x,计算x为不同值时反应后的体积V。
(4)根据(3)的计算结果,在图上画出V随x变化的曲线。
24. 利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为: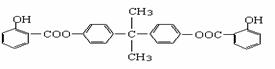 BAD的合成路线如下:
BAD的合成路线如下: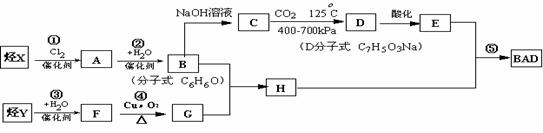
试回答下列空白:
(1)写出结构简式Y D 。
(2)属于取代反应的有 (填数字序号)
(3)1 mol BAD最多可与含 molNaOH的溶液完全反应
(4)写出方程式:反应④
B+G→H 。
23. 有A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个。已知
① 2.6g液态A在3.92L(标准状况,下同)氧气中,经点燃后两者均确好完全反应得到2.8L二氧化碳和液态水。
② A不能发生消去反应,但能与C发生聚合反应生成高分子物质―聚酯D(同时生成小分子)
③ B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E。
完成下列空白:
(1) A的结构式为: 。
(2)B分子内脱去一个水分子形成环状的化合物E,E的结构式为: 。
(3)A与C可形成缩聚物D(生成高分子的同时还生成小分子),D的结构简式为 。
(4)B/ 与B互为同分异构体,且是同类物质,则B/的结构简式可能是:
。
 21.Ⅰ、汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:反应Ⅰ HgS +O2
Hg +SO2
21.Ⅰ、汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:反应Ⅰ HgS +O2
Hg +SO2
 反应Ⅱ 4HgS +4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS +4CaO 4Hg +3CaS + CaSO4
请完成下列空白:
①HgS与氧气反应,氧化剂是 。
②请标出反应Ⅱ中电子转移的方向和数目。
③得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
④已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+
 Hg22+ ,提高Hg22+浓度的方法是:
。
Hg22+ ,提高Hg22+浓度的方法是:
。
Ⅱ、在2L的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g) 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1。
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1。
⑴温度不变,若缩小容器的体积,则平衡_______移动(填正向、逆向或不)
⑵维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是________。 A、4molA+2molB B、2molC+1molD
C、2molA+1molB+2molC+1molD D、1molA+0.5molB+1molC+0.2molD
⑶若维持容器的体积和温度不变,按不同配比加入起始物质,达到平衡时,C的浓度仍是0.4mol·L-1。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是_____ ___
②若加入0.2molA和0.1molB,则C和D起始物质的量分别应满足_________,________
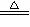
22.已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。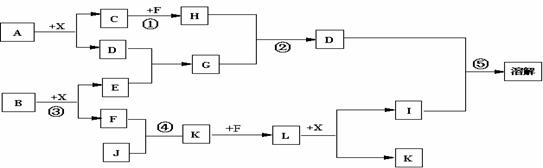
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
20.二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
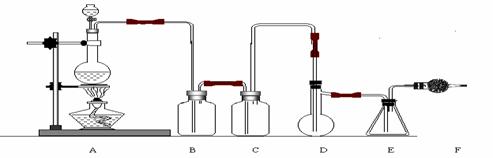
试填写下列空白:
(1)装置A中发生反应的化学方程式为: 。
(2)装置B盛放的药品是 C中是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59℃,最好采用何种方式 加热 。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 作用是: 。
(6)二氯化硫电子式为: 由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为: 。
19.碱式氯化铜(不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)为验证其组成并确定X值,某学生设计了以下几步实验。
① 取a g的晶体制成粉末。
② 晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③ 另取a g的晶体,溶于足量某溶剂中充分溶解得到溶液。
④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器 (填仪器名称,下同);灼烧晶体时是在 中进行。以上四步中,用到玻璃棒的步骤有 (选填:①②③④)
B.步骤②灼烧后得到的固体应为:
C.步骤③所用的溶剂可能是
D.步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量
E.若组成符合通式,则计算X的表达式为: (用字母表示)。
18.由氧化铜和氧化铁的混合物ag,加入2molL-1的硫酸溶液50mL,恰好完全溶解,若将ag的该混合物在H2中加热充分反应,冷却后剩余固体质量为
A、1.6a g B、(a-1.6)g C、(a-3.2) g D、无法计算
第Ⅱ卷 (非选择题)
17.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L。将溶液蒸干灼烧得固体w2g。下列所列关系式中正确的是
A. 35.5a V2 =w2-w1 B. 23n(Na)+27n(Al)=w1
C. n(Na)+3n(Al)=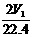 D. a V2
=
D. a V2
=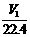
16.将下列各组括号内的少量杂质除去的操作正确的是
A.FeCl2溶液(FeCl3):加足量的铁粉,振荡、过滤
B.乙醇(水): 加浓H2SO4 蒸馏
C.O2(H2、H2O): 通过浓硫酸洗气,再通过灼热的CuO 粉末
D.甲醛溶液(甲酸): 加Na2CO3 蒸馏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com