
题目列表(包括答案和解析)
19.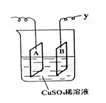 .下图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为x 、 y。
.下图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为x 、 y。
(1)当以I=0.21A的电流电解60分钟后,测得铜片A的质量增加了0.25g ,则图中装置的x端应与直流电的 极相连,它是电解池的 极。
(2)电解后铜片B的质量 。(答增加、减少或不变)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
(1)负 ,阴 (2)减少 (3)
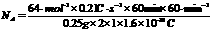
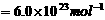
18. 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
17.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
16.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
15.右图A为直流电源,B为渗透饱和
氯化钠溶液和酚酞试液的滤纸,C为电镀槽,
接通电路后,发现B 上的 C 点显红色,
请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,
使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或
 (只要求填两种电解质溶液)。
(只要求填两种电解质溶液)。
(1)正 (2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
14.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是
 A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2
13.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2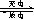 Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
12.(2001上海14)氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在l-100nm之间 B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成 D.呈红褐色
11.铜片和锌片用导线连接后插入稀硫酸中,锌片是
A.阴极 B.正极 C.阳极 D.负极
10.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
① 以上反应是可逆反应 ② 以上反应不是可逆反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A ①③ B ②④ C ①④ D ②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(很是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是 锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液。(3)锂的摩尔质量小 :2Li+ZH2O→LiOH+H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com