
题目列表(包括答案和解析)
29.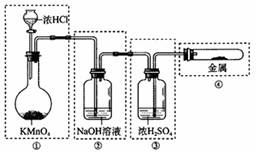 已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)
已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)
A.只有④处 B.只有②处
C.只有②和③处 D.②、③、④处
28.有人对常温常压下气体单质(除稀有气体以外)作如下描述:
①化学性质都很活泼;②都是无色气体;③都是双原子分子
你认为其中错误的是
A.只有①和③ B.只有①和② C.只有②和③ D.①、②和③
27.在溶液中能与AlO2-大量共存的是
A.OH- B.Al3+ C.Cu2+ D.NH4+
下列说法不正确的是
A.蔗糖不是淀粉水解的产物 B.蔗糖的水解产物能发生银镜反应
C.蔗糖是多羟基的醛类化合物 D.蔗糖与麦芽糖互为同分异构体
26.取0.1 mol下列氢氧化物置于1 L水中,充分搅拌后,溶液碱性最弱的是
A.Mg(OH)2 B.KOH C.Ba(OH)2 D.NaOH
相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是
A.NaHSO4、CH3COONa、NH4Cl、NaNO3 B.NaNO3、CH3COONa、NaHSO4、NH4Cl
C.CH3COONa、NaNO3、NH4Cl、NaHSO4 D.NaNO3、CH3COONa、NH4Cl、NaHSO4
25.下列说法中,正确的是
A.铅笔芯的主要成分是金属铅
B.CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO
C.臭氧层的破坏对人类健康有害
D.绿色食品是指使用化肥和农药生产出来的农副产品
26.(10分)石油化工是江苏省的支柱产业之一,聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2=CH2 +Cl2 → CH2Cl-CH2Cl……………………………①
CH2Cl-CH2Cl → CH2 = CHCl +HCl……………………… ②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率= 实际产量/理论产量)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。
(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2= CH2 +4HCl +O2→ 2CH2Cl-CH2Cl +2H2O………………………③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中即不生成氯化氢,也不消耗氯化氢)。
25.(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001 mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
24.(10分)环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
 CH2
CH2
CH2
CH2


 CH + CH2 → CH CH2 (也可表示为
CH + CH2 → CH CH2 (也可表示为 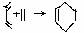 )
)
CH CH2 CH CH2
CH2 CH2
丁二烯 乙烯 环己烯
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
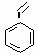
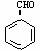
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
丁二烯→① A →② B →③ C →④ D →⑤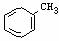 △
△
请按要求填空:
(1)A的结构简式是 ;B的结构简式是 。
(2)写出下列反应的化学方程式和反应类型:
反应④ ,反应类型 。
反应⑤ ,反应类型 。
23.(8分)含有氨基(-NH2)的化合物通常能够与盐酸反应,生成盐酸盐。如:
R-NH2 +HCl →R-NH2·HCl (R-代表烷基、苯基等)
现有两种化合物A和B,它们互为同分异构体。已知:
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3 溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;
④它们的组成 元素只可能是C、H、O、N、Cl 中的几种。
请按要求填空:
(1)A和B的分子式是 。
(2)A的结构简式是 ;B的结构简式是 。
22.1919年,Langmuir 提出等电子原理:原子数相同、电子总数相同的分子、互称为等电子体。等电子体的结构相似,物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com