
题目列表(包括答案和解析)
8.为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑的方法,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1-2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是
A Fe3+易水解,它的水解产物之一能抑制的Fe2+ 水解
B Fe2+ 有较强的还原性,它能还原Fe3+
C Fe3+有较强的氧化性,它能氧化Fe2+
D Fe3+的水解是吸热反应,升温能促进它的水解
7.25℃时,在0.1mol/L NaX溶液中,水的电离度为a1;在0.1mol/L盐酸中,水的电离度为a2,若a1/a2=109,则NaX溶液的pH值为
A 5 B 7 C 10 D 11
6.在室温下等体积的酸和碱的溶液,混和后pH值一定等于7的是
A pH=3的硝酸跟pH=11的氢氧化钾溶液
B pH=3的盐酸跟pH=11的氨水
C pH=3的硫酸跟pH=11的氢氧化钠溶液
D pH=3的硫酸跟pH=11的氢氧化钡溶液
5.常温下的下列物质中,含离子数目最多的是
A 20mL冰醋酸 B 20mL0.2mol/L的CH3COOH溶液
C 20mL0.2mol/L的BaCl2溶液 D 20mL0.15mol/L的AlCl3溶液
4.室温时,0.01 mol·L-1某一元弱酸的电离度为1%,则下列说法正确的是
A 上述弱酸溶液的pH=4
B 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
C 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7
D 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
3.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2,三种溶液,若测得其中[NH4+]分别为a、b、c(单位:mol/L),则下列判断正确的是
A a=b=c B c>a>b C b>a>c D a>c>b
2.在一个密闭容器中用等物质量的A和B发生如下的反应:A(g)+2B(g)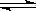 2C(g) 反应达到平衡时若A和B的物质的量之和与C的物质的量相等,则此时A的转化率为
2C(g) 反应达到平衡时若A和B的物质的量之和与C的物质的量相等,则此时A的转化率为
A 50% B 60% C 40% D 70%
1.将1molN2和3molH2反应,达到平衡时,混和气体中含92%(体积百分含量)的NH3,则H2体积百分含量为
A 2% B 3% C 4% D 6%
12.(16分)A、B、C、D、E属于短周期元素。已知它们都不是稀有气体元素,A的原子半径最大,B元素的原子最外层电子数为m,次层电子数为n,C元素的原子L层电子数为m+n,M层电子数m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1。
(1)写出元素符号:A 、B 、C 、D 、E
(2)A和B能以原子数1 : 1形成一种化合物,该化合物的电子式为 。
(3)A和B再分别配上C、D、E以三种元素组成化合物的种类数为 。
(4)仅B分别配上C、D、E以两种元素组成化合物的种类数为 。
11.(14分)已知a、b、c是中学化学中常见的三种物质,并用具有 的转化关
系。“→”表示在一定条件下,物质转化可经过一步完成(注:①反应条件未给出,如是否加热;②物质的浓稀程度变化属物理变化,可以不计作一步反应。)。
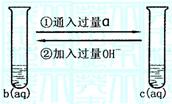
(1)反应情况如图: 已知b物质是侯德榜先生生产的“红
三角”牌并获国际金奖的物质。写出反应的离子方程式:
① ②
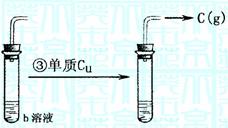
(2)反应情况如图:
已知b物质为常用的强酸,并且可以用铝容器贮存或运输,b物质可选情况较多,请回答以下两种情况及相关问题:
(I)若b物质为 ,则a 、c (以上填写化学式,下同)。
③的化学反应方程式为
(II)若b物质为 ,则a 、c 。
③的化学反应方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com