
题目列表(包括答案和解析)
29.将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
27.将0.1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中c(OH-)减少
28若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
26.将 a g 含NaOH样品溶解在 b mL 0.l mol·L-1 的硫酸中,再加入 c mL 0.1 mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中 NaOH 的纯度是(NaOH 式量为 40)
A. [ (b-c)/125a]×100% B. [(b-2c)/125a]×100%
C.[ (b-c)/250a]×100% D.[ (8b-8c)/a]×100%
25.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
(1)100mL容量瓶(注:未标明规格的扣 分) (2)>b(多选扣分) (3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
24.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=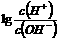 ,则下列叙述正确的是
,则下列叙述正确的是
A.中性溶液的AG=0 B.酸性溶液的AG<0
C.常温下0.lmol/L氢氧化钠溶液的AG=12 D.常温下0.lmol/L盐酸溶液的AG=12
23.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
22.在一支25 mL的酸式滴定管中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
21.在锌片和盐酸的反应中,加入下列试剂,可是生成氢气的速率变慢的是
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
20.将氨水逐滴加入到稀盐酸中,使溶液成中性,则此时
A.c(NH4+)=c(Cl-) B.c(NH4+)>c(Cl-)
C.c(NH4+)<c(Cl-) D.c(NH4+)与c(Cl-)之间关系不确定
19.室温下0.1mol·L-1NaOH溶液滴定amL某浓度的HCl溶液,达到终点时消耗NaOH溶液bmL,此时溶液中氢离子的浓度c(H+)/mol·L-1是
A.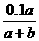 B.
B.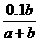 C.1×107 D.1×10-7
C.1×107 D.1×10-7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com