
题目列表(包括答案和解析)
1、分别用下列仪器量取一定量的溶液俯视读数,液体体积一定偏高的是
(A)滴定管 (B)刻度移液管 (C)量筒 (D)容量瓶
28.(14分)
钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[ Co(NH3)xCly ]Clz的
组成,进行如下实验:
①称取样品0.5010 g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。
产生的氨用50.00 mL 0.5000 mol•L-1的盐酸完全吸收并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL, 用0.1000 mol•L-1 NaOH滴定,消耗NaOH溶液30.00 mL。
...... ②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com+ + I- → Co2+ + I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000 mol•L-1Na2S2O3溶液20.00 mL。反应方程式为:I2 + 2Na2S2O3 == 2NaI + Na2S4O6
③另称取该物质样品0.2505 g溶于水,以0.1000 mol•L-1 AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应式为:
[ Co(NH3)xCly ]Clz + zAgNO3 == [ Co(NH3)xCly ](NO3)z + zAgCl↓
通过计算求:
(1) [ Co(NH3)xCly ]Clz中氮元素的质量分数。
27.(6分)
合成氨工业生产中所用的α―Fe催化剂的主要成分是FeO、Fe2O3 。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (用小数表示,保留2位小数)。
 (3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3 + C 4FeO + CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中
加入炭粉的质量为 g 。
26.(8分)
.... 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、
Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
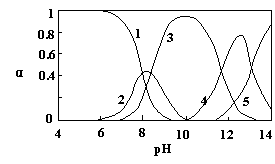
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2、,4表示Pb(OH)3-,5表示Pb(OH)42-]
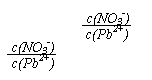 (1) Pb(NO3)2溶液中, 2(填“>”、“=”、“<”);往该溶液中滴入氯
(1) Pb(NO3)2溶液中, 2(填“>”、“=”、“<”);往该溶液中滴入氯
化铵溶液后, 增大,可能的原因是 。
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH = 8时溶液中存在的阳离子(Na+除外)有
,pH = 9时,主要反应的离子方程式为 。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
|
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
|
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
|
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s) + Pb2+ E2Pb(s) + 2H+
E2Pb(s) + 2H+
则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
25.(8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是:温度升高,K值 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g) + H2O(g)  CO2(g) + H2 (g) △H1 <0
CO2(g) + H2 (g) △H1 <0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)= mol/(L•min)
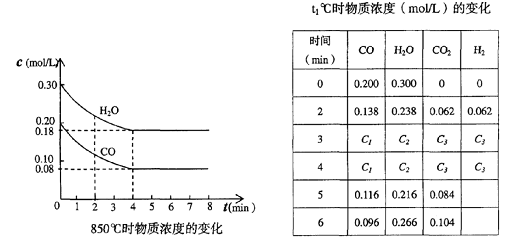
(3) t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于 状态;
C1数值 0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24.(13分)
...... 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在
某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该
Mg(OH)2的生产工艺如下:
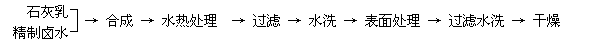
.... (1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],
反应的化学方程式为 。
.... (2)合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx•mH2O]== (1-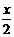 ) Mg(OH)2 +
) Mg(OH)2 +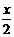 MgCl2 + mH2O
MgCl2 + mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流
程中与此有关的步骤是 。
(4)已知热化学方程式:
Mg(OH)2(s) == MgO(s) + H2O(g) △H1 = +81.5 kJ·mol-1
Al(OH)3(s) ==
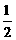 Al2O3(s) +
Al2O3(s) + 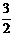 H2O(g) △H 2 = +87.7 kJ·mol-1
H2O(g) △H 2 = +87.7 kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,
主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是
(填代号),理由是 。
23.(6分)
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则
(1) Y是 、Z是 (填元素名称)。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是(离子符号) 和 。
(4) X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是 。
22.(12分)
.... 某研究小组进行与NH3有关的系列实验。
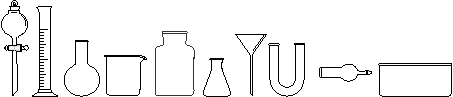
(1) 从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、
胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为 。
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如第6页右上图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略);HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好。
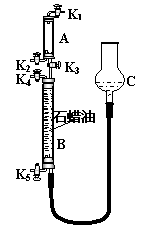 ①在A管中充满与大气压强相等的干燥HCl气体。操作是
①在A管中充满与大气压强相等的干燥HCl气体。操作是
。
控制活塞K4、K5,调节C,使B管充满与A管同压的干
燥NH3。
②缓缓开启K3,A管中的现象是 。
要达到实验目的,当反应完成并恢复到室温时,B管中预
期的现象是 ;
若观察不到预期现象,主要原因是 。
21.(13分)
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅。
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥HCl气体反应制得SiHCl3: Si + 3HCl SiHCl3 + H2
③ SiHCl3与过量H2在1000-1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量
SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
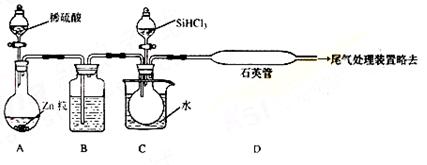
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是:
。
②装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
20.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g) + Y(g) 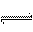 Z(g) + W(s) △H>0下列叙述正确的是
Z(g) + W(s) △H>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应到达平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的△H增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com