
题目列表(包括答案和解析)
1.B 2.C 3.D 4.C 5.B 6.C 7.B 8.A 9.BD 10.AB 11.BC 12.C 13.D 14.C 15.B 16.A 17.CD 18.A
26.(10分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=_________。
(2)当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的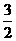 时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
(3)a的取值范围是____________________________。
(4)b的取值范围是____________________________。
高三教学调研测试
25.(7分)已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO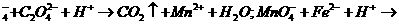 Fe3++Mn2++H2O。
Fe3++Mn2++H2O。
现称取草酸亚铁[FeC2O4]样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol·L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1)
试分别配平下列两个离子反应式。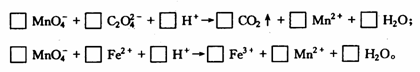
(2) 求样品中草酸亚铁的质量分数。
24.(13分)据报道,目前抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种,它与雷米封同时服用,可以产生协同作用。已知: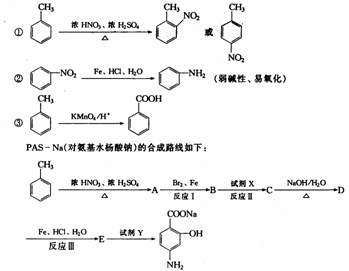
请回答下列问题:
(1)
 写出下列反应的化学方程式:
写出下列反应的化学方程式:
A→B:______________________
(2)写出下列物质的结构简式:
C__________________,D_______________________。
(2) 指出反应类型:反应Ⅰ___________,反应Ⅱ______________,反应Ⅲ___________。
(3) 所加试剂名称:X___________,Y___________________。
23.(10分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色;A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液反应。
(1)A可能发生的反应有__________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是_____________、________________。
(3)B分子中没有支链,其结构简式是_________,与B具有相同官能团的同分异构体的结构简式是__________________。
(4)由B制取A的化学方程式是_______________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:

天门冬氨酸的结构简式是__________________________。
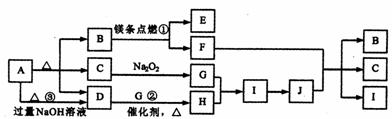
22.(8分)下图是某些常见物质的转化关系图,图中部分反应物或生成物没有列出。其中A是农业生产中常用的化肥,且分解得到相等物质的量的B、C、D。B是直线型非极性分子, D、J是工业上用途很广的两种重要的化工原料,H、I是典型的大气污染物,E是一种耐高温材料。
 请按要求填空:
请按要求填空:
(1) D的电子式_________,其分子的空间结构为_____________形。
(2) 反应①、②的化学方程式为:
①______________________________;②_______________________。
(3) 反应③的离子方程式为_________________________________________。
21.(8分)将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1) 当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为____________mol。
(2) 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3) 若在另外一个2 L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A. c(NO)=0.35 mol·L-1或c(NO)=0.09 mol·L-1
B. c(NO2)=0.4 mol·L-1
C. c(NO2)=0.35 mol·L-1
D. c(O2)=0.2 mol·L-1或c(NO)=0.4 mol·L-1
20.(17分)在实验室常用锌粒跟稀硫酸起反应而制得的氢气,含有水蒸气等杂质;被干燥后,经催化剂的作用,再跟干燥的氮气起反应,生成氨气。
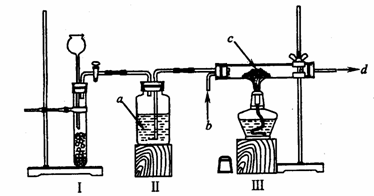
(1)根据上述要求,小强同学尝试安装了以下装置。
试填空:
① 请指出上述装置中的错误之处:________________;________________。
② 装置Ⅲ的作用是________________。
③ 写出箭头所标试剂的名称:a_________; b__________; c__________; d_________。
再简答下列问题:
(2)为什么不能用浓硫酸跟锌起反应来制得氢气?
________________________________________________________________。
(3)为什么不能用铜跟稀硫酸起反应来制取氢气?
________________________________________________________________。
(4)干燥的氢气里可能混用二氧化硫、硫化铜、氮气、二氧化碳等杂质。把这种氢气顺次通过硝酸铅溶液和氢氧化钠溶液,每种溶液能除去什么杂质?
________________________________________________________________。
(5)怎样检验生成的氨气?
________________________________________________________________。
19.(3分)下列实验操作能达到的预期效果的是______________。
A.用pH试纸测定某液体是否为酸。
B.实验室制取乙烯时必须将温度计的水银球插入反应液中,以控制反应液的温度。
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现。
D.向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液。
E.向20 mL沸水中滴加数滴饱和FeCl3的溶液,加热片刻,可制得Fe(OH)3胶体。
F.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
18.在一固定体积的密闭容器中,可逆反应,nA(g)+mg(B) pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=v(A)n/m。
A.③④⑤ B.②③④ C. ③④⑥ D.①②③
第Ⅱ卷(非选择题 共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com