
题目列表(包括答案和解析)
8.甲、乙、丙、丁各是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀 甲+丙→沉淀 乙+丙→沉淀
丙十丁→沉淀 乙+丁→无色刺激性气味气体,
则甲、乙、丙、丁依次是( )
A Na2SO3 HCl AgNO3 BaCl2
B BaCl2 Na2SO3 HCl AgNO3
C BaCl2 Na2SO3 AgNO3 HCl
D AgNO3 HCl BaCl2 Na2SO3
7. 在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.HCl
B.Cl2
C.CO
D.NH3
6.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等 B.O2比O3质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
5.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.31g 白磷分子(P4)中含有P-P键个数为1.5×6.02×1023
B.48gO2和48gO3所含分子数为3×6.02×1023
C.1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023
D.20g 重水(D2O)中含有的中子数为8×6.02×1023
4.已知充分燃烧a g乙炔气体生成1molCO2气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol
B.C2H2(g)+5/2O2(g) 2CO2(g)+H2O(l);△H=+2b kJ/mol
C.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+b kJ/mol
3.下列离子方程式书写不正确的是 ( )
A 向纯碱溶液中加入醋酸溶液
CO32-+2H+=CO2↑+H2O
B.在氯化铝溶液中加入过量氨水 Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+
C.在碳酸氢钠溶液中加入等物质的量的氢氧化钡溶液
HCO3-+OH- + Ba2+ = BaCO3↓+H2O
D.在硫酸氢钠溶液中加入等物质的量的氢氧化钡溶液
H+ + SO42- + Ba2+ + OH-= BaSO4↓ + H2O
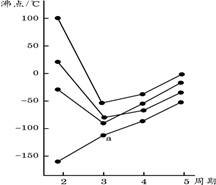
2.右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl C.PH3 D.SiH4
1、2006年3月5日,温家宝在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证。你认为下列行为中有悖于这一保证的是 ( )
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.将煤进行气法处理,提高煤的综合利用效率
C.研究采煤、采油新技术,且提高产量以满足工业生产的快速发展
 D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
23.(13分)已知A为中学化学中的常见金属,X、Y为常见非金属,A、X、Y都位于周期表中短周期。其中A、Y常温下为固体,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解,分解产物为E和HCl。现用A与石墨作电极,BCY的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):

请填写下列空白:
(1)金属A为 ;操作a是将D溶液在HCl气流中蒸干,原因是
。
(2)反应②的化学方程式为: ;
反应⑤的化学方程式为: 。
(3)原电池反应①中,正极反应式为: 。
22.(11分)某研究性学习小组为测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,设计了如下实验步骤:
①准确称量样品质量a g;
②向样品中加入10mL 6mol·L-1的盐酸,样品溶解后再加入蒸馏水配成100mL溶液;
③向上述溶液中加入3mL氯水,搅拌使其反应完全;
④加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后干燥;
⑥将沉淀移至坩埚中,灼烧、冷却、称重,并反复操作多次至固体完全反应。试回答问题:
(1)写出步骤④中产生沉淀的离子方程式:________________________。
(2)确认步骤④沉淀已经完全的方法是____________________________________。
(3)洗涤沉淀的操作方法是______________________________________________;
如何检验沉淀是否洗净,其方法是________________________________________。
(4)在步骤⑥中,判断固体反应完全的方法是:
(5)若空坩埚质量为b g,充分灼烧固体完全反应后,剩余固体和坩埚的总质量为
c g,则样品中铁元素的质量分数是______________________×100%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com