
题目列表(包括答案和解析)
2、下列各组物质中,化学键类型和晶体类型都相同的是
A.KCl 和KOH B.Cl2和H2 C.CO2 和SiO2 D.NH4Cl 和KI
1、下列说法中,正确的是
A.非极性共价键只存在于单质中
B.离子键只能存在于化合物中
C.分子晶体里只存在分子间作用力,不存在化学键
D.具有正四面体结构的分子,如CH4、CCl4、P4等,其中键角都是109°28’
16. 短周期元素 X 和 Y 可以形成 XY4 型化合物, 若 X 的原子序数为 m , Y 的原子序数为 n , 则 m 和n 的相互关系为:
A. m – 13 = n B. n + 5 = m
C. m + 8 = n D. n – 11 = m
 高三上学期第二次月考化学试题
高三上学期第二次月考化学试题
15.在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300oC,经充分
反应后排出气体,则残留固体及其物质的量不正确的是
|
|
A |
B |
C |
D |
|
反应前 |
1molNaOH、1molNaHCO3 |
1molNa2O、1molNaHCO3 |
1mo1Na2O2、lmolNaHCO3 |
1molNa2O2、1molNH4HCO3 |
|
反应后 |
1molNa2CO3 |
1molNaOH、0.5molNa2CO3 |
1molNaOH、1molNa2CO3 |
1molNa2CO3 |
14.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
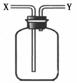 ①瓶内盛一定量液体干燥剂,用于干燥气体
①瓶内盛一定量液体干燥剂,用于干燥气体
②瓶内盛一定量液体洗涤剂,用于除去气体中的某些杂质
③瓶内盛水,用于测量难溶于水的气体体积
④瓶内贮存难溶于水的气体,加入水使气体排出
⑤用于收集密度大于空气的气体
⑥用于收集密度小于空气的气体
A.①③ B.②④ C.③⑤ D.③⑥
13.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至沉淀刚好完全:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B.过量铁粉与氯化铁溶液反应,溶液变浅绿色:
Fe + Fe3+ == 2Fe2+
C.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.将少量SO2气体通入NaClO溶液中:
SO2 + H2O + ClO-=SO42-+ Cl- + 2H+
12. 云溪一中某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
云溪一中某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
11. 下列关于晶体的说法一定正确的是
下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
10. 下列说法正确的是
A. 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2
B. SO2气体使品红溶液褪色,表现了SO2的氧化性
C. 浓盐酸和MnO2反应时,浓盐酸中的HCl全部被氧化
D. 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移
9. 阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是:
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5×6.02×1023
B.1 mol Na2O2与足量的水反应,转移的电子数为2×6.02×1023
C.6.02×1023个SO3分子在标准状况下的体积为22.4 L
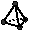 D.常温常压下,62g白磷分子( )中的共价键数为6×6.02×1023
D.常温常压下,62g白磷分子( )中的共价键数为6×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com