
题目列表(包括答案和解析)
4.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
A.2Na218O2 + 2H2O == 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
 C.NH4Cl
+ 2H2O
C.NH4Cl
+ 2H2O 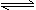 NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O
3.表示下列变化的化学用语正确的是
A.NaHCO3的水解:HCO3-+H2 O 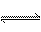 H3O++CO32-
H3O++CO32-
B.金属铝溶于NaOH溶液:Al+2OH- == A1O2-+H2↑
C.钢铁吸氧腐蚀的正极反应:4OH- -4e- == O2↑+2H2O
D.1 L0. 5 mol·L-1稀硫酸与1 L 1 mol·L-1氢氧化钠溶液反应放出57. 3kJ的热量:
H2S04(aq) + 2NaOH(aq) == Na2S04(aq) + 2H20(1);△H=-114.6 kJ/mol
1.近期北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S=2H++S 2-
|
Al2O3 + N2 + 3 C === 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝合成反应中,N2是还原剂,Al2O3是氧化剂 B.氮化铝晶体属于分子晶体
C.氮化铝中氮元素化合价为-3 D.上述反应中每生成2 mol AlN,N2得到3 mol电子
29、某金属锡样品的纯度可通过下述方法分析:将试样溶于酸,反应方程式为:
 Sn+2HCl
SnCl2+H2↑ 再加入过量 FeCl3 溶液,发生如下反应:
Sn+2HCl
SnCl2+H2↑ 再加入过量 FeCl3 溶液,发生如下反应:
 SnCl2+2 FeCl3 2 FeCl2+SnCl4 ,最后用已知浓度的 K2Cr2O7 溶液滴定生成的Fe2+,反应式为:
SnCl2+2 FeCl3 2 FeCl2+SnCl4 ,最后用已知浓度的 K2Cr2O7 溶液滴定生成的Fe2+,反应式为:
 6FeCl2+K2Cr2O7 +14HCl 6FeCl3 +2KCl+2CrCl3+7H2O
6FeCl2+K2Cr2O7 +14HCl 6FeCl3 +2KCl+2CrCl3+7H2O
现有该金属试样0.613克,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液16.0ml。
请列式求解试样中锡的质量分数(假定杂质不参加反应)。(相对原子质量 Sn-119)
28、 在一定条件下可发生反应:2SO2(g)+O2 (g) 2SO3(g)。现取8L SO2和6L O2混合,当反应达到平衡后,测得混合气体的体积减小10% 。求:
在一定条件下可发生反应:2SO2(g)+O2 (g) 2SO3(g)。现取8L SO2和6L O2混合,当反应达到平衡后,测得混合气体的体积减小10% 。求:
(1)SO2的转化率。
(2)平衡混合气体中SO3的体积分数。
27、化合物A(C8H8O3)为无色液体,难溶于水,从A开始,可发生图示的一系列反应,图中H的化学式为C6H6O,G能发生银镜反应,A硝化时可生成两种一硝基取代物。
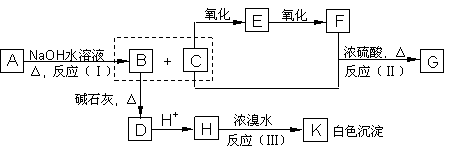

(1) 写出下列化合物可能的结构简式:
A___________________,E___________________。
(2) 写出反应类型:(Ⅰ)__________(Ⅱ)__________(Ⅲ)__________
(3)
 写出化学方程式:H K ___________________________________________;
写出化学方程式:H K ___________________________________________;
 C E _____________________________________________;
C E _____________________________________________;
 C+F G___________________________________________。
C+F G___________________________________________。
26、具有强烈催化作用的有机物质二乙烯酮,是由单体乙烯酮(CH2=C=O)聚合而成的。已知乙烯酮可与含活泼氢原子的化合物在不同的条件下发生加成反应(见图示),生成各种化合物(加成的取向完全一样),如与氯化氢加成生成乙酰氯。
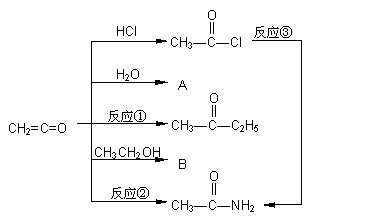

回答下列问题:
(1) 写出A、B的结构简式:A___________________,B__________________。
(2) 反应①的化学方程式______________________________________;
反应②的化学方程式______________________________________;
反应③是乙酰氯与过量氨水混合而发生的,其化学方程式为
______________________________________。
25、 在10.0℃和2×105Pa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(维持温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度(压强增大到一定程度时,E可能会发生状态的改变):
在10.0℃和2×105Pa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(维持温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度(压强增大到一定程度时,E可能会发生状态的改变):
|
压强(Pa) |
2×105 |
5×105 |
1×106 |
|
D的浓度(mol/L) |
0.085 |
0.20 |
0.44 |
根据表中压强和浓度变化的数据关系,回答下列问题:
(1) 压强从2×105增加到5×105Pa时,平衡向______(正或逆)反应方向移动,理由是_________________________________________________。
(2) 压强从5×105增加到1×106Pa时,平衡向________(正或逆)反应方向移动,理由是________________________________________,这可能是由于__________________。
24、 298K时,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+92.4KJ/mol
298K时,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+92.4KJ/mol
在该温度下,取1mol N2和3mol H2放在一密闭容器中,在催化剂催化下进行反应,测得反应放出的热量总是小于92.4KJ,其原因是__________________________________________。
23、 在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:A2 0.5mol/L,B2 0.1mol/L,C 1.6mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)a、b应满足的关系式是____________________________;
在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:A2 0.5mol/L,B2 0.1mol/L,C 1.6mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)a、b应满足的关系式是____________________________;
(2)a的取值范围是___________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com