
题目列表(包括答案和解析)
26.(6分)下列有关实验的叙述,正确的是 ▲ (填序号)。
A.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.无法用分液漏斗将甘油和水的混合液体分离
D.用酸式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.用浓氨水洗涤做过银镜反应的试管
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
H.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
J.在氢氧化铁胶体中加少量硫酸会产生沉淀
K.用结晶法可以除去硝酸钾中混有的少量氯化钠
25.(6分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出元素符号:A ▲ 、B ▲ ;
 (2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ▲ ;
(2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ▲ ;
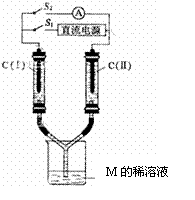
(3)如图所示装置,两玻璃管中盛满A、B、C三种元素组成的化合物M的稀溶液,C(Ⅰ)、C(Ⅱ)为多孔铂电极。接通S1后,两玻璃管中有气体生成,C(Ⅰ)极的玻璃管内的气体约是C(Ⅱ)的二分之一。一段时间后(两玻璃管中液面未脱离电极),断开S1 ,接通S2,电流表的指针发生偏转。此时:
① C(I)的电极名称是 ▲ (填写“正极”或“负极”);
② C(II)的电极反应式是 ▲ 。
24.(6分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 ▲ (填写编号);
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 ▲ (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ▲ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ▲ ;
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 ▲ (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ▲ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ▲ ;
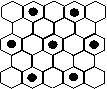
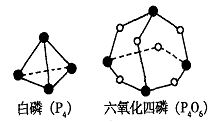
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,则该物质的化学式为 ▲ 。
23.(4分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为
▲ ;
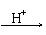 (2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO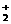 ,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:VO
,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:VO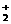 +H2C2O4
VO++CO2+H2O(未配平),
+H2C2O4
VO++CO2+H2O(未配平),
其中还原剂是 ▲ 。若消耗0.9 g草酸,所对应钒元素质量是 ▲ g。
22. (6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 ▲ 、 ▲ 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ▲ ;
(6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 ▲ 、 ▲ 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ▲ ;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是
▲ 。
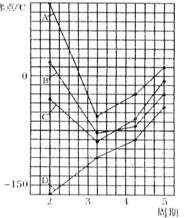
21.(8分)下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,
根据各图表示的结构特点,写出该分子的化学式:
A ▲ 、 B ▲ 、C ▲ 、D ▲ 。
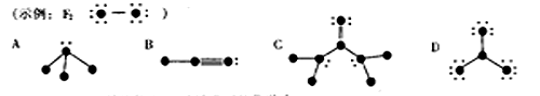
20. 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、O=O 498kJ·mol-1。则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol-1 B.一1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
第Ⅱ卷(非选择题,共60分)
18.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.由“Cl2+H2O=HCl+HClO”反应可推出 “F2+H2O =HF+HFO” 反应也能发生
B. NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
19.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的硫化羰(COS),已知硫化羰分子中所有原子均满足八电子结构,结合所学元素周期表知识,下列说法正确的是
A.硫化羰分子中三个原子不在同一直线上 B.硫化羰属于非极性分子
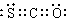 C.硫化羰沸点比CO2低
D.硫化羰的电子式为
C.硫化羰沸点比CO2低
D.硫化羰的电子式为
17.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中过氧离子和超氧离子的物质的量之比为
A 1 : 1 B 1 : 2 C 1 : 3 D 2 : 1
16.已知A和B是第二或第三周期元素,可在同一周期,也可以在不同周期,两者可形成AmBn 型离子化合物,若A的原子序数为x,则B的原子序数不可能是
A.x – m– n + 16 B.x – m – n + 8 C.x + m + n – 8 + 18 D.x – m – n
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com