
题目列表(包括答案和解析)
4.(05上海)6、设阿伏加德常数为NA。则下列说法正确的是( )
A、 常温常压下,11.2L甲烷中含有的氢原子数为2NA
B、 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D、常温睛,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
3.(05江苏)10.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L甲烷和乙烷混合气体中的分子数约为 ×6.02×1023
×6.02×1023
2.(05全国卷Ⅱ)9.NA代表阿伏加德常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
1.(05广东)3、 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A、10g甲烷所含有的电子数目为10NA
B、常温常压下,4g氦气所含有的中子数目为4NA
C、标准状况下,22.4L单质溴所含有的原子数目为2NA
D、电解食盐水若产生2g氢气,则转移的电子数目为2NA
16. (16分)少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2将试样中I-氧化成IO3-;②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3-还原为I2;③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。通过上述步骤可测得碘化物中I-的含量。
要求:⑴写出步骤①②中发生反应的离子方程式:
① ②
⑵若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是多少?
⑶若在测定时,准确取含KI的样品溶液25.00mL,终点时耗用0.100mol/L Na2S2O3 20.06mL,试计算试液中KI的含量(g/L)。
15.(05广东21、)(10分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有_______________(填代号,限填3项)。A、试管 B、瓷坩埚 C、坩埚钳 D、铁三角架E、泥三角 F、洒精灯 G、烧杯 H、墨筒
(2)第2步:Iˉ溶液的获取。操作是_________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用_________(填代号)。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
理由是__________________________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
14.(05天津26.)(18分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
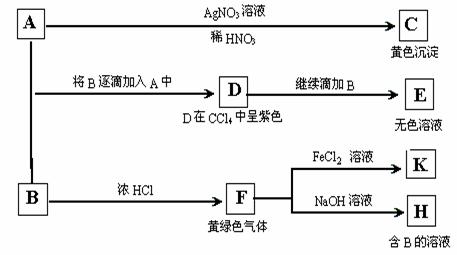
请回答:⑴ 出A、B和C的化学式:A_______________,B______________,C____________。
⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
___________________________________;_____________________________________。
⑶ 写出将SO2气体通入K溶液发生反应的离子方程式:______________________________。
⑷ 写出由F→H的化学方程式:____________________________________________。
13.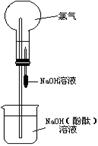 (16分)某研究性学习小组在做氯气的喷泉实验时(装置如图),发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。甲、乙两位同学对此现象分别做了如下推测:
(16分)某研究性学习小组在做氯气的喷泉实验时(装置如图),发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。甲、乙两位同学对此现象分别做了如下推测:
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性.所以溶液红色褪去。乙:因为氯气溶于水并与水反应生成HClO.由于HClO的氧化漂白作用而使溶液褪色。
(1) 验证甲同学的推测是否正确的方法是:
;
验证乙同学的推测是否正确的方法是:
;
(2) 类似“褪色喷泉实验”还有多种“变色的喷泉实验”,请按实验要求,分别设计1个“变色喷泉实验”并填写下列表格:
|
编号 |
实验要求 |
烧杯中的溶液 |
滴管中的液体 |
烧瓶中的气体 |
|
① |
无色变红色喷泉 |
|
H2O |
|
|
② |
红色变无色喷泉 |
|
|
SO2 |
12. 在一密闭容器中盛有a LCl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为a L。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是( )
A.Cl2︰H2=1 B. Cl2︰H2≥1 C.Cl2︰H2<1 D. Cl2︰H2≤1
第I卷答题表 班考号 姓名
第Ⅱ卷(非选择题共60分)
11.实验室制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在烧瓶中加入二氧化锰粉末 ④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤ C ①③④②⑤ D ①④③②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com