
题目列表(包括答案和解析)
22.(6分)2I-+ClO-+2H+ == I2 + Cl-+H2O; SO32-+I2+H2O== SO42-+2I-+ 2H+;
ClO->I2>SO42-
21.(8分)(1)1、5、8、1、5、4 (2)0.007 (3)19.6 (4)40%
第Ⅱ卷(非选择题,共60分)
30.(5分)在过量氧气中煅烧1g含SiO2的黄铁矿,残余固体为0.8g。若生产过程中有2%的硫损失,则生产490t 98%的H2SO4,理论上需要这种黄铁矿多少吨?
高三第一次月考化学试卷评分标准
第Ⅰ卷(选择题,共40分)
29.(6分)有一硝酸盐晶体,其化学式为M(NO3)x·nH2O,式量是242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属离子全部析出,经称量阴极增重0.32g。求:
(1)金属M的相对原子质量,及x、n的值;
(2)电解后溶液的pH(假设电解前后溶液的体积不变)。
28.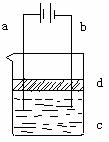 (6分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
(6分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
(1)a电极的反应式为 ▲ ;
(2)电解液c可以是 ▲ (选填编号);
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d是苯层,其作用为 ▲ ,在加入苯之前应对c溶液进 行如何处理? ▲
(4)为了在较短时间内看到白色沉淀,可采取的措施是 ▲ (选填编号);
A.改用稀硫酸做电解液 B.适当增加电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c用硫酸钠溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除在电极上可以看到气泡外,混合物中另一明显现象为 ▲ 。
27.(6分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
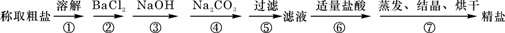
(1)判断BaCl2已过量的方法是 ▲ ;
(2)第④步中,相关的离子方程式是 ▲ ;
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
▲ 。
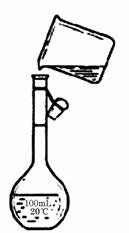
(4)为检验精盐纯度,需配制150 mL0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是 ▲ 。
26.(7分)根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
(1)本实验至少需要加热 ▲ 次,至少需要称量 ▲ 次;
(2)某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4·nH2O中n的值(用ml、m2、m3表示):ω= ▲ ,n = ▲ ;
(3)若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生结果 ▲ (填“偏高”或“偏低”)?
从下列分析中选出该生实验产生误差的原因可能是(填写字母) ▲ 。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量差大于0.1g
C.加热后容器未放在干燥器中冷却 D.加热过程中有少量晶体溅出
E.加热后的粉末中有少量黑色固体
25.(6分)如图所示,若电解5min时铜电极质量增加2.16g,试回答:
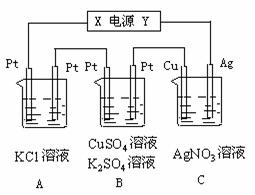
(1)电源电极X名称为 ▲ ;
(2)pH变化:A ▲ 、B ▲ 、C ▲ ;
(3)通过5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为 ▲ 。
24.(6分)有四种同族(系列)的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
|
1 |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
2 |
F2 -187.0 |
Cl2 -33.6 |
(a)
58.7 |
I2 184.0 |
|
3 |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
4 |
H2O (z) |
H2S -60.2 |
(b)
-42.0 |
H2Te -1.8 |
试根据上表回答下列问题:
(1)写出系列2中物质主要化学性质的递变规律(任写1种) ▲ ,能够说明该递变规律的化学事实是 ▲ (任举1例,用离子方程式表示);
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是 ▲ ;
(3)上表中, ▲ 和 ▲ 两种物质的沸点较同系列其它物质反常,反常的主要原因是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com