
题目列表(包括答案和解析)
7.下列各组中,两种气体的分子数一定相等的是:
A.温度相同、体积相同的O2和N2 B.体积相等、密度不等的N2和C2H4
C.体积相等、密度相等的CO和C2H4 D.压力相同、体积相同的N2和O2
6.下列各组离子一定能大量共存的是:
A.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Mg2+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
5.下列叙述不正确的是:
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,应选择酚酞作指示剂
C.AgCl + NaBr == AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) == H2O (l);△H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g) △H = -283 KJ/mol
C8H18 (l) + 25/2O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O (l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是:
A.H2 (g) B.CO(g) C.C8H18 (l) D.CH4 (g)
3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、
陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3C  2AlN + 3CO。下列叙述正确的是:
2AlN + 3CO。下列叙述正确的是:
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3 D.氮化铝晶体属于分子晶体
2.氢叠氮酸(HN3)与醋酸性质相似,其盐稳定,但是在受到撞击时发生爆炸生成氮气。有关氢叠氮酸及其盐的叙述不正确的是:
A、NaN3可用于汽车防撞保护囊 B、NaN3的水溶液呈碱性
C、NaN3 的固体属于离子晶体 D、HN3分子中各原子都满足于8个电子稳定结构
1.保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是:
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
25.(10分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式_______________________________;
(2)产物中硝酸铜的物质的量______________mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol;
(4)如混合物中Cu的物质的量为X,求X的取值范围________________。
24.(8分)碘盐是日常生活中必不可少的调味品,我国强制推广食用加碘盐。根据GB5461--《国家食用盐标准》,碘元素含量为20-50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去12mL。
有关反应如下:
①IO3-+5I-+6 H+ 3I2+3H2O
3I2+3H2O
②I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
(1)用硫代硫酸钠溶液滴定I2时,应用_________作指示剂,滴定到终点的现象是________;
(2)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
23.(10分)塑料是日常生活中常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
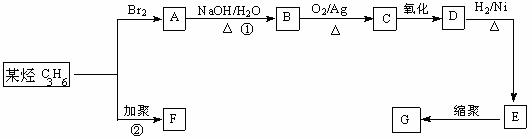
(1)写出高分子化合物G的结构简式:_____________________;
(2)写出反应①的化学方程式:_________________________________________;
(3)写出反应②化学方程式:_____________________________________________;
(4)PBT(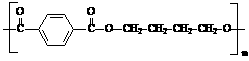 )是一种最重要的工程塑料之一。
)是一种最重要的工程塑料之一。
已知:①、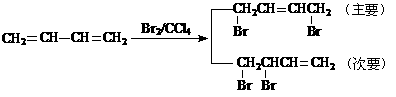
②、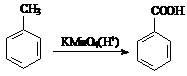
请设计方案以CH2=CHCH=CH2、 为原料合成PBT;请用反应流程图表示,并注明反应条件。
为原料合成PBT;请用反应流程图表示,并注明反应条件。
示例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
合成PBT的反应流程图为__________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com