
题目列表(包括答案和解析)
17.常温下,体积相等,pH值都是3的盐酸和醋酸,分别加水稀释到pH等于4,然后用
16.设NA为阿佛加德罗常数,下列说法不正确的是:
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
15.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是:
A.X、Y、Z的稳定性逐渐减弱 B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
14.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是:
A.pH>7,且 c(OH-) > c(Na+) >c(CH3COO-)>c(H+)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
C.pH<7,且c(CH3COO-) > c(H+) >c(Na+)> c(OH-)
D.pH=7,且c(CH3COO-) > c(Na+) >c(H+) = c(OH-)
13.对反应 4NH3(g)+5O2(g)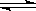 4NO(g)+6H2O(g)(正反应放热),下列有
4NO(g)+6H2O(g)(正反应放热),下列有
关叙述正确的是:
A.对NH3与O2的反应来说,化学反应速率关系是2v(NH3)=3v(H2O)
B.若单位时间内生成X mol NO的同时,消耗X mol NH3,则反应达到平衡状态
C.达到化学平衡时,若扩大容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,达到新的化学平衡时,NO的体积分数将增大
12.下列反应的离子方程式错误的是:
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-==BaCO3↓+NH3·H2O+H2O
C.在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-==2Fe2++2Cl-+Br2
D.过量CO2通入氢氧化钠溶液中:CO2+2OH-==CO32-+H2O
11. 科学家最近发现2种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是:
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式O4
10.常温下,在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH =11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是:
A.1:9 B.1:1 C.1:2 D.1:4
9.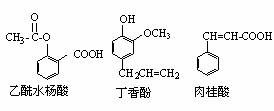 可用于鉴别以下三种化合物的一组试剂是:
可用于鉴别以下三种化合物的一组试剂是:
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
8.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是:
①向FeC13溶液中滴加KI溶液,再加入CC14振荡,CCl4层呈紫红色
②向FeC12溶液中加入氯水,再加入KSCN溶液,呈红色
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去
A.I2>C12>Fe3+>MnO4- B.MnO4->C12>Fe3+>I2
C.Cl2>I2>Fe3+>MnO4- D.Fe3+>MnO4->Cl2>I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com